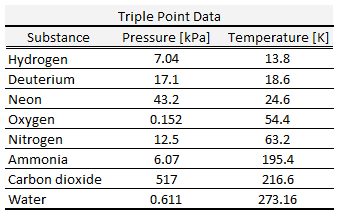
Triple punto de agua
Fuente: wikipedia.org CC BY-SA
En termodinámica, el punto triple de una sustancia es la combinación única de temperatura y presión a la que la fase sólida , la fase líquida y la fase gaseosa pueden coexistir en equilibrio termodinámico.
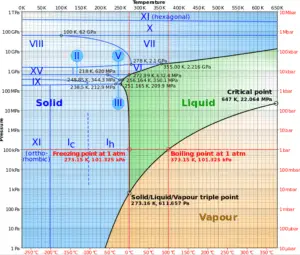
Por acuerdo internacional, al punto triple del agua se le ha asignado un valor de 273.16 K (0.01 ° C; 32.02 ° F) y una presión de vapor parcial de 611.66 pascales (6.1166 mbar; 0.0060366 atm) . En ese punto, es posible cambiar toda la sustancia a vapor, agua o hielo haciendo cambios arbitrariamente pequeños en la presión y la temperatura. Incluso si la presión total está muy por encima del punto triple del agua, siempre que la presión parcial del vapor de agua sea de 611.657 pascales, el sistema aún puede llevarse al punto triple del agua.
El punto triple del agua , T 3 = 273.16 K, es la temperatura estándar de punto fijo para la calibración de termómetros. Este acuerdo también establece el tamaño del kelvin como 1 / 273.16 de la diferencia entre la temperatura de punto triple del agua y el cero absoluto.
El diagrama de fases del agua es un diagrama de presión-temperatura para el agua que muestra cómo las tres fases (sólido, líquido y vapor) pueden coexistir juntas en equilibrio térmico. A lo largo de la línea de vaporización, las fases líquida y de vapor están en equilibrio, a lo largo de la línea de fusión, las fases sólida y líquida están en equilibrio y a lo largo de la línea de sublimación, las fases sólida y de vapor están en equilibrio. El único punto en el que las tres fases pueden existir en equilibrio es el punto triple.
El punto triple del agua corresponde a la presión mínima a la que puede existir agua en estado líquido. A presiones por debajo del punto triple (como en el espacio exterior), el hielo sólido cuando se calienta a presión constante se convierte directamente en vapor de agua en un proceso conocido como sublimación . En general, la sublimación es un cambio de fase de una sustancia directamente desde la fase sólida a la fase gaseosa sin pasar a través de la fase líquida intermedia. Por encima del punto triple, el hielo sólido cuando se calienta a presión constante primero se derrite para formar agua líquida, y luego se evapora para formar vapor de agua.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.