Tripelpunkt
Quelle: wikipedia.org CC BY-SA
In der Thermodynamik ist der Tripelpunkt einer Substanz die einzigartige Kombination von Temperatur und Druck, bei der feste Phase , flüssige Phase und gasförmige Phase im thermodynamischen Gleichgewicht koexistieren können .
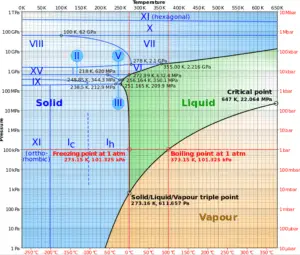
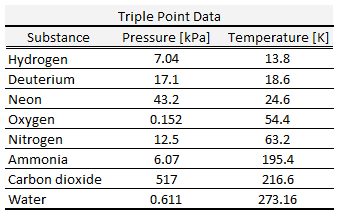
Gemäß internationaler Vereinbarung wurde dem Tripelpunkt von Wasser ein Wert von 273,16 K (0,01 ° C) und ein Partialdampfdruck von 611,66 Pascal (6,1166 mbar; 0,0060366 atm) zugewiesen . Zu diesem Zeitpunkt ist es möglich, die gesamte Substanz in Dampf, Wasser oder Eis umzuwandeln, indem beliebig kleine Druck- und Temperaturänderungen vorgenommen werden. Selbst wenn der Gesamtdruck deutlich über dem Tripelpunkt von Wasser liegt, vorausgesetzt, der Partialdruck des Wasserdampfes beträgt 611,657 Pascal, kann das System immer noch auf den Tripelpunkt von Wasser gebracht werden.
Der Tripelpunkt von Wasser , T 3 = 273,16 K, ist die Standard-Festpunkttemperatur für die Kalibrierung von Thermometern. Diese Vereinbarung legt auch die Größe des Kelvins als 1 / 273.16 der Differenz zwischen der Dreipunkttemperatur von Wasser und dem absoluten Nullpunkt fest.
Das Phasendiagramm von Wasser ist ein Druck-Temperatur-Diagramm für Wasser, das zeigt, wie alle drei Phasen (fest, flüssig und dampfförmig) im thermischen Gleichgewicht zusammen existieren können. Entlang der Verdampfungslinie befinden sich die flüssige und die Dampfphase im Gleichgewicht, entlang der Schmelzlinie befinden sich die feste und die flüssige Phase im Gleichgewicht und entlang der Sublimationslinie befinden sich die feste und die Dampfphase im Gleichgewicht. Der einzige Punkt, an dem alle drei Phasen im Gleichgewicht existieren können, ist der Tripelpunkt.
Der Tripelpunkt von Wasser entspricht dem Mindestdruck, bei dem Wasser im flüssigen Zustand existieren kann. Bei Drücken unter dem Tripelpunkt (wie im Weltraum) wird festes Eis bei konstantem Druck nach einem als Sublimation bekannten Verfahren direkt in Wasserdampf umgewandelt . Im Allgemeinen ist Sublimation ein Phasenwechsel einer Substanz direkt von der festen in die Gasphase, ohne die flüssige Zwischenphase zu durchlaufen. Oberhalb des Tripelpunkts schmilzt festes Eis beim Erhitzen unter konstantem Druck zunächst zu flüssigem Wasser und verdampft dann zu Wasserdampf.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.