Ponto Triplo da Água
Fonte: wikipedia.org CC BY-SA
Na termodinâmica, o ponto triplo de uma substância é a combinação única de temperatura e pressão na qual fase sólida , fase líquida e fase gasosa podem coexistir no equilíbrio termodinâmico.
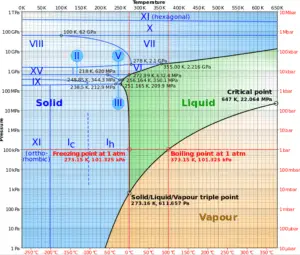
Por acordo internacional, o ponto triplo da água recebeu um valor de 273,16 K (0,01 ° C; 32,02 ° F) e uma pressão de vapor parcial de 611,66 pascal (6,1166 mbar; 0,0060366 atm) . Nesse ponto, é possível alterar toda a substância para vapor, água ou gelo fazendo arbitrariamente pequenas mudanças na pressão e na temperatura. Mesmo que a pressão total esteja bem acima do ponto triplo da água, desde que a pressão parcial do vapor de água seja de 611.657 pascal, o sistema ainda poderá ser levado ao ponto triplo da água.
O ponto triplo da água , T 3 = 273,16 K, é a temperatura de ponto fixo padrão para a calibração de termômetros. Este acordo também define o tamanho do kelvin como 1/273,16 da diferença entre a temperatura de ponto triplo da água e o zero absoluto.
O diagrama de fases da água é um diagrama de pressão-temperatura da água que mostra como as três fases (sólida, líquida e vapor) podem coexistir juntas em equilíbrio térmico. Ao longo da linha de vaporização, as fases líquida e de vapor estão em equilíbrio, ao longo da linha de fusão, as fases sólida e líquida estão em equilíbrio e, ao longo da linha de sublimação, as fases sólida e de vapor estão em equilíbrio. O único ponto no qual todas as três fases podem existir em equilíbrio é o ponto triplo.
O ponto triplo da água corresponde à pressão mínima na qual a água no estado líquido pode existir. Em pressões abaixo do ponto triplo (como no espaço sideral), o gelo sólido quando aquecido a pressão constante é convertido diretamente em vapor de água em um processo conhecido como sublimação . Em geral, a sublimação é uma mudança de fase de uma substância diretamente da fase sólida para a fase gasosa sem passar pela fase líquida intermediária. Acima do ponto triplo, o gelo sólido quando aquecido a pressão constante primeiro derrete para formar água líquida e depois evapora para formar vapor de água.
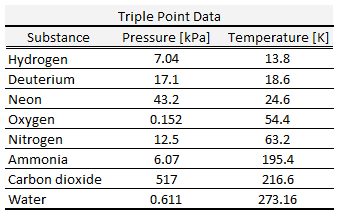
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.