Triple point d’eau
Source: wikipedia.org CC BY-SA
En thermodynamique, le triple point d’une substance est la combinaison unique de température et de pression à laquelle la phase solide , la phase liquide et la phase gazeuse peuvent toutes coexister en équilibre thermodynamique.
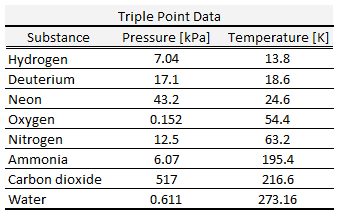
Selon l’accord international, la valeur du point triple de l’eau a été fixée à 273,16 K (0,01 ° C) et une pression de vapeur partielle de 611,66 pascals (6,166 mbar; 0,0060366 atm) . À ce stade, il est possible de transformer toute la substance en vapeur, en eau ou en glace en modifiant de manière arbitrairement minime la pression et la température. Même si la pression totale est bien supérieure au point triple de l’eau, à condition que la pression partielle de la vapeur d’eau soit de 611,657 pascals, le système peut toujours être amené au point triple de l’eau.
Le point triple de l’eau , T 3 = 273,16 K, est la température standard du point fixe pour l’étalonnage des thermomètres. Cet accord fixe également la taille du kelvin à 1 / 273,16 de la différence entre la température à trois points de l’eau et le zéro absolu.
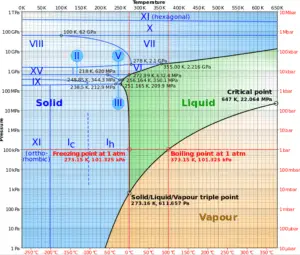
Le diagramme de phase de l’eau est un diagramme pression-température pour l’eau qui montre comment les trois phases (solide, liquide et vapeur) peuvent coexister ensemble en équilibre thermique. Le long de la ligne de vaporisation, les phases liquide et vapeur sont en équilibre, le long de la ligne de fusion, les phases solide et liquide sont en équilibre et le long de la ligne de sublimation, les phases solide et vapeur sont en équilibre. Le seul point où les trois phases peuvent exister en équilibre est le triple point.
Le point triple de l’eau correspond à la pression minimale à laquelle peut exister une eau à l’état liquide. Aux pressions inférieures au point triple (comme dans l’espace), la glace solide, lorsqu’elle est chauffée à pression constante, est convertie directement en vapeur d’eau selon un processus appelé sublimation . En général, la sublimation est un changement de phase d’une substance directement de la phase solide à la phase gazeuse sans passer par la phase liquide intermédiaire. Au-dessus du point triple, la glace solide, lorsqu’elle est chauffée à pression constante, fond d’abord pour former de l’eau liquide, puis s’évapore pour former de la vapeur d’eau.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci