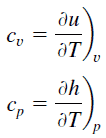Capacidade de calor
 Diferentes substâncias são afetadas em diferentes magnitudes pela adição de calor . Quando uma determinada quantidade de calor é adicionada a diferentes substâncias, suas temperaturas aumentam em diferentes quantidades. Essa constante de proporcionalidade entre o calor Q que o objeto absorve ou perde e a mudança de temperatura resultante T do objeto é conhecida como capacidade de calor C de um objeto.
Diferentes substâncias são afetadas em diferentes magnitudes pela adição de calor . Quando uma determinada quantidade de calor é adicionada a diferentes substâncias, suas temperaturas aumentam em diferentes quantidades. Essa constante de proporcionalidade entre o calor Q que o objeto absorve ou perde e a mudança de temperatura resultante T do objeto é conhecida como capacidade de calor C de um objeto.
C = Q / ΔT
A capacidade de calor é uma propriedade extensa da matéria, o que significa que é proporcional ao tamanho do sistema. A capacidade térmica C tem a unidade de energia por grau ou energia por kelvin. Ao expressar o mesmo fenômeno que uma propriedade intensiva , a capacidade de aquecimento é dividida pela quantidade de substância, massa ou volume, portanto, a quantidade é independente do tamanho ou extensão da amostra.
Capacidade específica de calor
A capacidade térmica de uma substância por unidade de massa é denominada capacidade térmica específica (c p ) da substância. O índice p indica que a capacidade térmica e a capacidade térmica específica se aplicam quando o calor é adicionado ou removido a pressão constante .
c p = Q / mΔT
Capacidade de calor específica do gás ideal
No Modelo de Gás Ideal , as propriedades intensivas c v e c p são definidas para substâncias compressíveis puras e simples como derivadas parciais da energia interna u (T, v) e entalpia h (T, p) , respectivamente:
onde os subscritos v e p denotam as variáveis mantidas fixas durante a diferenciação. As propriedades c v e c p são referidos como calores específicos (ou capacidades de calor ), porque, sob determinadas condições especiais dizem respeito a mudança de temperatura de um sistema para a quantidade de energia adicionada pela transferência de calor. As suas unidades SI são J / kg K ou J / mol K . Dois aquecimentos específicos são definidos para gases, um para volume constante (c v ) e outro para pressão constante (c p ) .
 De acordo com a primeira lei da termodinâmica , para processos de volume constante com um gás ideal monatômico, o calor molar específico será:
De acordo com a primeira lei da termodinâmica , para processos de volume constante com um gás ideal monatômico, o calor molar específico será:
C v = 3 / 2R = 12,5 J / mol K
Porque
U = 3 / 2nRT
Pode-se derivar que o calor molar específico a pressão constante é:
C p = C v + R = 5 / 2R = 20,8 J / mol K
Este C p é maior do que o calor específico molar a volume constante C v , porque a energia deve agora ser fornecidos não só para aumentar a temperatura do gás, mas também para o gás de trabalho para fazer porque neste volume caso alterações.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.