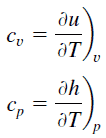Capacité thermique
 Différentes substances sont affectées à différentes magnitudes par l’ ajout de chaleur . Lorsqu’une quantité donnée de chaleur est ajoutée à différentes substances, leurs températures augmentent de manière différente. Cette constante de proportionnalité entre la chaleur Q absorbée ou perdue par l’objet et le changement de température T résultant de l’objet est appelée capacité calorifique C d’un objet.
Différentes substances sont affectées à différentes magnitudes par l’ ajout de chaleur . Lorsqu’une quantité donnée de chaleur est ajoutée à différentes substances, leurs températures augmentent de manière différente. Cette constante de proportionnalité entre la chaleur Q absorbée ou perdue par l’objet et le changement de température T résultant de l’objet est appelée capacité calorifique C d’un objet.
C = Q / ΔT
La capacité calorifique est une propriété étendue de la matière, ce qui signifie qu’elle est proportionnelle à la taille du système. La capacité calorifique C a l’unité d’énergie par degré ou d’énergie par kelvin. Lorsqu’on exprime le même phénomène en tant que propriété intensive , la capacité thermique est divisée par la quantité de substance, la masse ou le volume. La quantité est donc indépendante de la taille ou de l’étendue de l’échantillon.
La capacité thermique spécifique
La capacité thermique d’une substance par unité de masse s’appelle la capacité thermique spécifique (c p ) de la substance. L’indice p indique que la capacité thermique et la capacité thermique spécifique s’appliquent lorsque la chaleur est ajoutée ou retirée à une pression constante .
c p = Q / mΔT
Capacité thermique spécifique du gaz parfait
Dans le modèle de gaz parfait , les propriétés intensives c v et c p sont définies pour les substances compressibles pures et simples en tant que dérivées partielles de l’ énergie interne u (T, v) et de l’ enthalpie h (T, p) , respectivement:
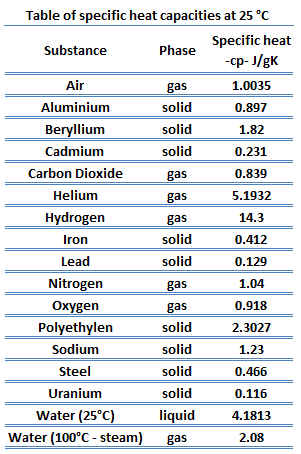
où les indices v et p désignent les variables maintenues fixes pendant la différenciation. Les propriétés c v et c p sont appelées chaleurs spécifiques (ou capacités calorifiques ) car dans certaines conditions particulières, elles relient le changement de température d’un système à la quantité d’énergie ajoutée par transfert de chaleur. Les unités SI sont J / kg K ou J / mole K . Deux chaleurs spécifiques sont définies pour les gaz, une pour un volume constant (c v ) et une pour une pression constante (c p ) .
 Selon la première loi de la thermodynamique , pour un procédé à volume constant avec un gaz parfait monatomique, la chaleur spécifique molaire sera:
Selon la première loi de la thermodynamique , pour un procédé à volume constant avec un gaz parfait monatomique, la chaleur spécifique molaire sera:
C v = 3 / 2R = 12,5 J / mol K
car
U = 3 / 2nRT
On peut déduire que la chaleur spécifique molaire à pression constante est:
C p = C v + R = 5 / 2R = 20,8 J / mol K
Ce C p est supérieur à la chaleur spécifique molaire à volume constant C v , car il faut désormais fournir de l’énergie non seulement pour élever la température du gaz mais aussi pour que le gaz fonctionne car dans ce cas le volume change.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci