Proceso isotérmico
Un proceso isotérmico es un proceso termodinámico , en el que la temperatura del sistema permanece constante (T = constante). La transferencia de calor dentro o fuera del sistema generalmente debe ocurrir a una velocidad tan lenta para ajustarse continuamente a la temperatura del depósito a través del intercambio de calor. En cada uno de estos estados se mantiene el equilibrio térmico .
Para un proceso ideal de gas y politrópico, el caso n = 1 corresponde a un proceso isotérmico (temperatura constante). A diferencia del proceso adiabático , en el que n = κ y un sistema no intercambia calor con su entorno (Q = 0; ∆T ≠ 0 ) , en un proceso isotérmico no hay cambio en la energía interna (debido a ∆T = 0 ) y, por lo tanto, ΔU = 0 (para gases ideales) y Q ≠ 0. Un proceso adiabático no es necesariamente un proceso isotérmico, ni un proceso isotérmico es necesariamente adiabático.
En ingeniería, los cambios de fase, como la evaporación o la fusión, son procesos isotérmicos cuando, como suele ser el caso, ocurren a presión y temperatura constantes.

Curva Isotérmica – Isoterma
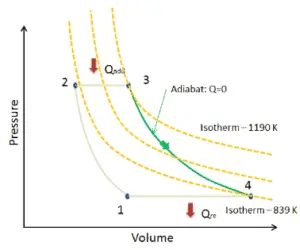
En un diagrama pV, el proceso ocurre a lo largo de una línea llamada curva isotérmica o isoterma . Esta curva tiene la ecuación p = constante / V . Se puede derivar de la ley de los gases ideales.
 En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El proceso isotérmico se puede expresar con la ley de los gases ideales como:
pV = constante
y la isoterma se puede expresar como:
p = constante / V
Corresponde a la Ley de Boyle-Mariotte , que establece que:
Para una masa fija de gas a temperatura constante, el volumen es inversamente proporcional a la presión.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.