Processus isothermique
Un processus isothermique est un processus thermodynamique dans lequel la température du système reste constante (T = const). Le transfert de chaleur à l’intérieur ou à l’extérieur du système doit généralement se faire à une vitesse aussi lente afin de s’adapter en permanence à la température du réservoir par le biais d’un échange de chaleur. Dans chacun de ces états, l’ équilibre thermique est maintenu.
Pour un gaz parfait et un processus polytropique, le cas n = 1 correspond à un processus isotherme (à température constante). Contrairement au processus adiabatique , dans lequel n = κ et un système n’échange aucune chaleur avec son environnement (Q = 0; ∆T ≠ 0 ) , dans un processus isothermique, il n’ya pas de changement de l’énergie interne (dû à T = 0 ) et donc ΔU = 0 (pour les gaz parfaits) et Q 0. Un processus adiabatique n’est pas nécessairement un processus isotherme, pas plus qu’un processus isothermique est nécessairement adiabatique.
En ingénierie, les changements de phase, tels que l’évaporation ou la fusion, sont des processus isothermiques lorsque, comme c’est habituellement le cas, ils se produisent à pression et température constantes.

Courbe isothermique – Isotherme
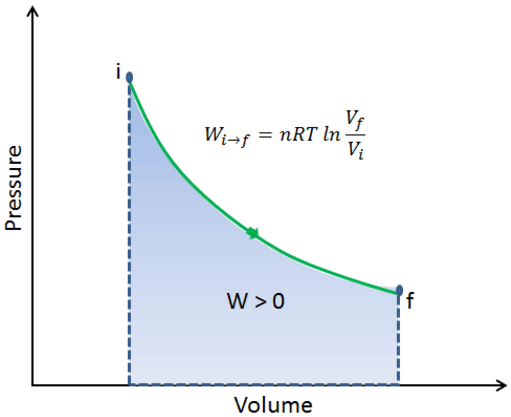
Sur un diagramme pV, le processus se déroule le long d’une ligne appelée courbe isotherme ou isotherme . Cette courbe a pour équation p = constante / V . Il peut être dérivé de la loi des gaz parfaits.
 Dans un gaz parfait , les molécules n’ont pas de volume et n’interagissent pas. Selon la loi du gaz parfait , la pression varie linéairement avec la température et la quantité, et inversement avec le volume .
Dans un gaz parfait , les molécules n’ont pas de volume et n’interagissent pas. Selon la loi du gaz parfait , la pression varie linéairement avec la température et la quantité, et inversement avec le volume .
pV = nRT
où:
- p est la pression absolue du gaz
- n est la quantité de substance
- T est la température absolue
- V est le volume
- R est la constante de gaz parfaite ou universelle, égale au produit de la constante de Boltzmann et de la constante d’Avogadro,
Dans cette équation, le symbole R est une constante appelée constante de gaz universelle qui a la même valeur pour tous les gaz, à savoir R = 8,31 J / mol K.
Le processus isotherme peut s’exprimer avec la loi du gaz parfait comme:
pV = constant
et l’ isotherme peut être exprimé comme:
p = constant / V
Elle correspond à la loi de Boyle-Mariotte qui stipule que:
Pour une masse fixe de gaz à température constante, le volume est inversement proportionnel à la pression.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci