Dirección de Procesos Termodinámicos
 Muchos procesos termodinámicos proceden naturalmente en una dirección pero no al contrario. Por ejemplo, cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío , nunca al revés. De hecho, dicho flujo de calor (de un cuerpo más frío a un sistema más cálido) no violaría la primera ley de la termodinámica , es decir, se conservaría la energía. Pero no sucede en la naturaleza.
Muchos procesos termodinámicos proceden naturalmente en una dirección pero no al contrario. Por ejemplo, cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío , nunca al revés. De hecho, dicho flujo de calor (de un cuerpo más frío a un sistema más cálido) no violaría la primera ley de la termodinámica , es decir, se conservaría la energía. Pero no sucede en la naturaleza.
Por ejemplo, quemar gasolina para impulsar automóviles es un proceso de conversión de energía en el que confiamos. La energía química en la gasolina se convierte en energía térmica , que luego se convierte en energía mecánica que hace que el automóvil se mueva. La energía mecánica se ha convertido en energía cinética . Cuando usamos los frenos para detener un automóvil, esa energía cinética se convierte por fricción en calor o energía térmica . En esta dirección inversa, hay muchos dispositivos que convierten el calor parcialmente en energía mecánica. Pero no se puede construir una máquina que convierta el calor por completo en energía mecánica. Siempre habrá pérdidas significativas de energía.
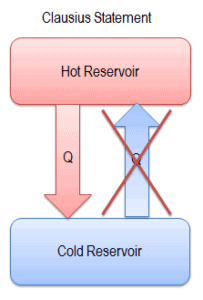
Las direcciones de los procesos termodinámicos están sujetas a la segunda ley de la termodinámica, especialmente a la Declaración de Clausius de la Segunda Ley .
“Es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente”.
El calor no puede fluir espontáneamente del sistema frío al sistema caliente sin realizar un trabajo externo en el sistema. Esto es exactamente lo que logran los refrigeradores y las bombas de calor. En un refrigerador, el calor fluye de frío a caliente, pero solo cuando es forzado por un trabajo externo, los refrigeradores son impulsados por motores eléctricos que requieren trabajo de su entorno para funcionar.
Las declaraciones de Clausius y Kelvin-Planck han demostrado ser equivalentes.