Ebullición por convección natural: inicio de ebullición de nucleato
Categorización por la temperatura de sobrecalentamiento de la pared, ΔT sat :
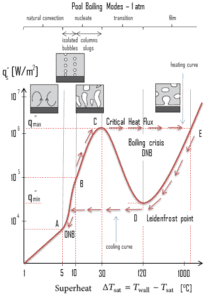 El trabajo pionero sobre la ebullición fue realizado en 1934 por S. Nukiyama , quien utilizó cables de nicromo y platino calentados eléctricamente sumergidos en líquidos en sus experimentos. Nukiyama fue el primero en identificar diferentes regímenes de ebullición de piscinas utilizando su aparato. Se dio cuenta de que la ebullición toma diferentes formas, dependiendo del valor de la temperatura de sobrecalentamiento de la pared ΔT sat (conocida también como el exceso de temperatura) , que se define como la diferencia entre la temperatura de la pared, la pared T y la temperatura de saturación, T sat .
El trabajo pionero sobre la ebullición fue realizado en 1934 por S. Nukiyama , quien utilizó cables de nicromo y platino calentados eléctricamente sumergidos en líquidos en sus experimentos. Nukiyama fue el primero en identificar diferentes regímenes de ebullición de piscinas utilizando su aparato. Se dio cuenta de que la ebullición toma diferentes formas, dependiendo del valor de la temperatura de sobrecalentamiento de la pared ΔT sat (conocida también como el exceso de temperatura) , que se define como la diferencia entre la temperatura de la pared, la pared T y la temperatura de saturación, T sat .
Se observan cuatro regímenes diferentes de ebullición de la ebullición de la piscina (en función del exceso de temperatura):
- Ebullición por convección natural ΔT sat <5 ° C
- Nucleato de ebullición 5 ° C < ΔT sat <30 ° C
- Transición Ebullición 30 ° C < ΔT sat <200 ° C
- Película en ebullición 200 ° C < ΔT sat
Ebullición por convección natural
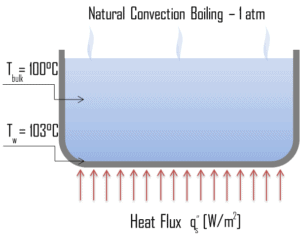 En termodinámica , el requisito para que ocurra la ebullición de sustancias puras es que T wall = T sat . Pero en experimentos reales, la ebullición no ocurre hasta que el líquido se calienta unos pocos grados por encima de la temperatura de saturación. La temperatura de la superficie debe estar algo por encima de la temperatura de saturación para mantener la formación de vapor. La ebullición por convección natural ocurre cuando ΔTsat <5 ° C. En este modo de ebullición , se observará vapor sobre la superficie del agua, pero generalmente no hay burbujas. será observado A medida que aumenta la temperatura de sobrecalentamiento, eventualmente se producirá el inicio de la burbuja, pero por debajo del punto A, el movimiento del fluido está determinado principalmente por las corrientes de convección naturales. El punto A generalmente se conoce como el inicio de la ebullición nucleada – ONB .
En termodinámica , el requisito para que ocurra la ebullición de sustancias puras es que T wall = T sat . Pero en experimentos reales, la ebullición no ocurre hasta que el líquido se calienta unos pocos grados por encima de la temperatura de saturación. La temperatura de la superficie debe estar algo por encima de la temperatura de saturación para mantener la formación de vapor. La ebullición por convección natural ocurre cuando ΔTsat <5 ° C. En este modo de ebullición , se observará vapor sobre la superficie del agua, pero generalmente no hay burbujas. será observado A medida que aumenta la temperatura de sobrecalentamiento, eventualmente se producirá el inicio de la burbuja, pero por debajo del punto A, el movimiento del fluido está determinado principalmente por las corrientes de convección naturales. El punto A generalmente se conoce como el inicio de la ebullición nucleada – ONB .
Hirviendo
Fuente: wikipedia.org CC BY-SA
En capítulos anteriores, hemos discutido la transferencia de calor por convección con una suposición muy importante. Asumimos una transferencia de calor por convección monofásica sin ningún cambio de fase. En este capítulo nos enfocamos en la transferencia de calor por convección asociada con el cambio en la fase de un fluido . En particular, consideramos procesos que pueden ocurrir en una interfaz sólido-líquido o sólido-vapor, a saber, ebullición (cambio de fase de líquido a vapor) y condensación ( cambio de fase de vapor a líquido).
Para estos casos, los efectos del calor latente asociados con el cambio de fase son significativos. El calor latente , conocido también como la entalpía de vaporización, es la cantidad de calor agregado o eliminado de una sustancia para producir un cambio de fase. Esta energía descompone las fuerzas de atracción intermoleculares, y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV ). Cuando se agrega calor latente , no ocurre cambio de temperatura.
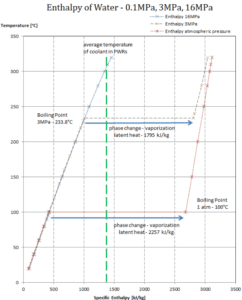
La entalpía de la vaporización es una función de la presión a la que tiene lugar esa transformación.
Calor latente de vaporización – agua a 0.1 MPa (presión atmosférica)
h lg = 2257 kJ / kg
Calor latente de vaporización – agua a 3 MPa
h lg = 1795 kJ / kg
Calor latente de vaporización: agua a 16 MPa (presión dentro de un presurizador )
h lg = 931 kJ / kg
El calor de vaporización disminuye al aumentar la presión, mientras que aumenta el punto de ebullición . Se desvanece por completo en un cierto punto llamado punto crítico . Por encima del punto crítico, las fases líquida y de vapor son indistinguibles, y la sustancia se llama fluido supercrítico .
 El cambio del estado líquido al vapor debido a la ebullición se mantiene mediante la transferencia de calor desde la superficie sólida; por el contrario, la condensación de un vapor al estado líquido da como resultado la transferencia de calor a la superficie sólida. La ebullición y la condensación difieren de otras formas de convección en que dependen del calor latente de vaporización , que es muy alto para presiones comunes , por lo tanto, se pueden transferir grandes cantidades de calor durante la ebullición y la condensación esencialmente a temperatura constante. Los coeficientes de transferencia de calor , h, asociados con la ebullición y la condensación suelen ser mucho más altos.que los encontrados en otras formas de procesos de convección que involucran una sola fase.
El cambio del estado líquido al vapor debido a la ebullición se mantiene mediante la transferencia de calor desde la superficie sólida; por el contrario, la condensación de un vapor al estado líquido da como resultado la transferencia de calor a la superficie sólida. La ebullición y la condensación difieren de otras formas de convección en que dependen del calor latente de vaporización , que es muy alto para presiones comunes , por lo tanto, se pueden transferir grandes cantidades de calor durante la ebullición y la condensación esencialmente a temperatura constante. Los coeficientes de transferencia de calor , h, asociados con la ebullición y la condensación suelen ser mucho más altos.que los encontrados en otras formas de procesos de convección que involucran una sola fase.
Esto se debe al hecho de que, incluso en flujo turbulento , hay una capa de película de fluido estancada (subcapa laminar) que aísla la superficie del intercambiador de calor. Esta capa de película de fluido estancada juega un papel crucial para el coeficiente de transferencia de calor por convección. Se observa que el fluido se detiene completamente en la superficie y asume una velocidad cero en relación con la superficie. Este fenómeno se conoce como la condición antideslizante y, por lo tanto, en la superficie, el flujo de energía ocurre puramente por conducción. Pero en las siguientes capas se producen movimientos de conducción y difusión de masa en el nivel molecular o macroscópico. Debido al movimiento de masa, la tasa de transferencia de energía es mayor. Como fue escrito,La ebullición de nucleados en la superficie altera efectivamente esta capa estancada y, por lo tanto, la ebullición de nucleados aumenta significativamente la capacidad de una superficie para transferir energía térmica al fluido a granel.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.