Ébullition par convection naturelle – Début de l’ébullition nucléée
Catégorisation par la température de surchauffe des murs, ΔT sat :
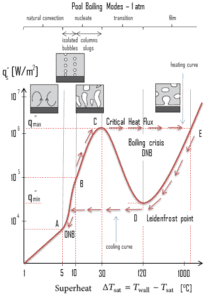 Le travail de pionnier en matière d’ébullition a été effectué en 1934 par S. Nukiyama , qui a utilisé des fils de nichrome et de platine chauffés électriquement immergés dans des liquides dans ses expériences. Nukiyama fut le premier à identifier différents régimes de piscine en ébullition à l’ aide de son appareil. Il a remarqué que l’ ébullition prend des formes différentes, en fonction de la valeur de la température de surchauffe de la paroi AT sat (également connu comme l’excès de température) , qui est définie comme la différence entre la température de paroi, T paroi et la température de saturation, T sat .
Le travail de pionnier en matière d’ébullition a été effectué en 1934 par S. Nukiyama , qui a utilisé des fils de nichrome et de platine chauffés électriquement immergés dans des liquides dans ses expériences. Nukiyama fut le premier à identifier différents régimes de piscine en ébullition à l’ aide de son appareil. Il a remarqué que l’ ébullition prend des formes différentes, en fonction de la valeur de la température de surchauffe de la paroi AT sat (également connu comme l’excès de température) , qui est définie comme la différence entre la température de paroi, T paroi et la température de saturation, T sat .
On observe quatre régimes différents d’ébullition en piscine (basés sur l’excès de température):
- Point d’ébullition par convection naturelle ΔT sat <5 ° C
- Nucléate en ébullition 5 ° C < ΔT sat <30 ° C
- Transition d’ébullition 30 ° C < ΔT sat <200 ° C
- Film en ébullition 200 ° C < ΔT sat
Ébullition par convection naturelle
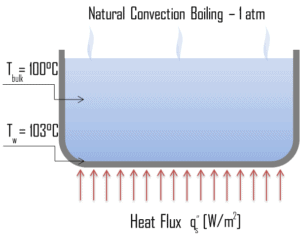 En thermodynamique , la condition pour que les substances pures soient bouillies est que T mur = T sat . Mais dans les expériences réelles, l’ébullition ne se produit pas tant que le liquide n’a pas chauffé quelques degrés au-dessus de la température de saturation. La température de surface doit être légèrement supérieure à la température de saturation afin de maintenir la formation de vapeur. Il y a ébullition par convection naturelle lorsque ΔTsat <5 ° C. Dans ce mode d’ébullition , de la vapeur sera observée à la surface de l’eau, mais généralement pas de bulles sera observé. Au fur et à mesure que la température de surchauffe augmente, la formation de bulles se produira éventuellement, mais en dessous du point A, le mouvement du fluide est déterminé principalement par les courants de convection naturelle. Le point A est généralement appelé début de l’ébullition nucléée – ONB .
En thermodynamique , la condition pour que les substances pures soient bouillies est que T mur = T sat . Mais dans les expériences réelles, l’ébullition ne se produit pas tant que le liquide n’a pas chauffé quelques degrés au-dessus de la température de saturation. La température de surface doit être légèrement supérieure à la température de saturation afin de maintenir la formation de vapeur. Il y a ébullition par convection naturelle lorsque ΔTsat <5 ° C. Dans ce mode d’ébullition , de la vapeur sera observée à la surface de l’eau, mais généralement pas de bulles sera observé. Au fur et à mesure que la température de surchauffe augmente, la formation de bulles se produira éventuellement, mais en dessous du point A, le mouvement du fluide est déterminé principalement par les courants de convection naturelle. Le point A est généralement appelé début de l’ébullition nucléée – ONB .
Ébullition
Source: wikipedia.org CC BY-SA
Dans les chapitres précédents, nous avons discuté du transfert de chaleur par convection avec une hypothèse très importante. Nous avons supposé un transfert de chaleur convectif monophasé sans aucun changement de phase. Dans ce chapitre, nous nous concentrons sur le transfert de chaleur par convection associé au changement de phase d’un fluide . En particulier, nous considérons les processus qui peuvent se produire à une interface solide-liquide ou solide-vapeur, à savoir l’ ébullition (changement de phase liquide-vapeur) et la condensation ( changement de phase vapeur-liquide).
Dans ces cas, les effets de la chaleur latente associés au changement de phase sont importants. La chaleur latente , également connue sous le nom d’enthalpie de vaporisation, est la quantité de chaleur ajoutée ou retirée d’une substance pour produire un changement de phase. Cette énergie décompose les forces d’attraction intermoléculaires, et doit également fournir l’énergie nécessaire à l’expansion du gaz (le travail pΔV ). Lorsque de la chaleur latente est ajoutée, aucun changement de température ne se produit.
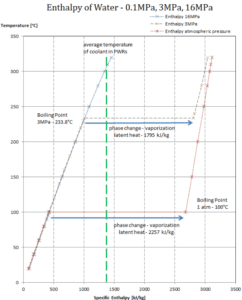
L’ enthalpie de vaporisation est fonction de la pression à laquelle cette transformation a lieu.
Chaleur latente de vaporisation – eau à 0,1 MPa (pression atmosphérique)
h lg = 2257 kJ / kg
Chaleur latente de vaporisation – eau à 3 MPa
h lg = 1795 kJ / kg
Chaleur latente de vaporisation – eau à 16 MPa (pression à l’intérieur d’un pressuriseur )
h lg = 931 kJ / kg
La chaleur de vaporisation diminue avec l’augmentation de la pression, tandis que le point d’ébullition augmente. Elle disparaît complètement à un certain point appelé le point critique . Au-dessus du point critique, les phases liquide et vapeur sont indiscernables et la substance est appelée fluide supercritique .
 Le passage du liquide à l’état de vapeur dû à l’ ébullition est soutenu par le transfert de chaleur de la surface solide; à l’inverse, la condensation d’une vapeur à l’état liquide entraîne un transfert de chaleur vers la surface solide. L’ébullition et la condensation diffèrent des autres formes de convection en ce qu’elles dépendent de la chaleur latente de vaporisation , qui est très élevée pour les pressions courantes , donc de grandes quantités de chaleur peuvent être transférées pendant l’ébullition et la condensation essentiellement à température constante. Les coefficients de transfert de chaleur , h, associés à l’ ébullition et à la condensation sont généralement beaucoup plus élevésque ceux rencontrés dans d’autres formes de processus de convection qui impliquent une seule phase.
Le passage du liquide à l’état de vapeur dû à l’ ébullition est soutenu par le transfert de chaleur de la surface solide; à l’inverse, la condensation d’une vapeur à l’état liquide entraîne un transfert de chaleur vers la surface solide. L’ébullition et la condensation diffèrent des autres formes de convection en ce qu’elles dépendent de la chaleur latente de vaporisation , qui est très élevée pour les pressions courantes , donc de grandes quantités de chaleur peuvent être transférées pendant l’ébullition et la condensation essentiellement à température constante. Les coefficients de transfert de chaleur , h, associés à l’ ébullition et à la condensation sont généralement beaucoup plus élevésque ceux rencontrés dans d’autres formes de processus de convection qui impliquent une seule phase.
Cela est dû au fait que, même en écoulement turbulent , il existe une couche de film fluide stagnant (sous-couche laminaire), qui isole la surface de l’échangeur de chaleur. Cette couche de film fluide stagnant joue un rôle crucial pour le coefficient de transfert de chaleur convectif. On observe que le fluide s’arrête complètement à la surface et prend une vitesse nulle par rapport à la surface. Ce phénomène est connu sous le nom de condition antidérapante et donc, à la surface, le flux d’énergie se produit uniquement par conduction. Mais dans les couches suivantes, il se produit à la fois un mouvement de conduction et de diffusion-masse au niveau moléculaire ou au niveau macroscopique. En raison du mouvement de masse, le taux de transfert d’énergie est plus élevé. Comme il a été écrit,l’ébullition nucléée à la surface perturbe efficacement cette couche stagnante et, par conséquent, l’ébullition nucléée augmente considérablement la capacité d’une surface à transférer de l’énergie thermique au fluide en vrac.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci