Fórmulas de entalpía en unidades extensas
H = U + pV
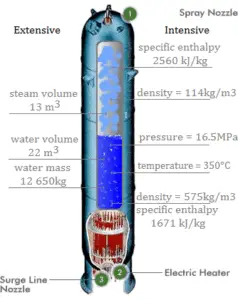
La entalpía es una cantidad extensa, depende del tamaño del sistema o de la cantidad de sustancia que contiene. La unidad de entalpía del SI es el joule (J). Es la energía contenida dentro del sistema, excluyendo la energía cinética de movimiento del sistema como un todo y la energía potencial del sistema como un todo debido a los campos de fuerza externos. Es la cantidad termodinámica equivalente al contenido de calor total de un sistema.
Por otro lado, la energía puede almacenarse en los enlaces químicos entre los átomos que forman las moléculas. Este almacenamiento de energía a nivel atómico incluye energía asociada con estados orbitales de electrones, espín nuclear y fuerzas de unión en el núcleo.
La entalpía está representada por el símbolo H , y el cambio en la entalpía en un proceso es H 2 – H 1 .
Hay fórmulas de entalpía en términos de variables más familiares como la temperatura y la presión :
dH = C p dT + V (1-αT) dp
Donde C p es la capacidad calorífica a presión constante y α es el coeficiente de expansión térmica (cúbica). Para gas ideal αT = 1 y por lo tanto:
dH = C p dT
Fórmulas de entalpía en unidades intensivas – Entalpía específica
La entalpía se puede convertir en una variable intensiva o específica dividiéndola por la masa . Los ingenieros usan la entalpía específica en el análisis termodinámico más que la entalpía misma. La entalpía específica (h) de una sustancia es su entalpía por unidad de masa. Es igual a la entalpía total (H) dividida por la masa total (m).
h = H / m
dónde:
h = entalpía específica (J / kg)
H = entalpía (J)
m = masa (kg)
Tenga en cuenta que la entalpía es la cantidad termodinámica equivalente al contenido total de calor de un sistema. La entalpía específica es igual a la energía interna específica del sistema más el producto de presión y volumen específico .
h = u + pv
En general, la entalpía es una propiedad de una sustancia , como la presión, la temperatura y el volumen, pero no se puede medir directamente. Normalmente, la entalpía de una sustancia se da con respecto a algún valor de referencia. Por ejemplo, la entalpía específica de agua o vapor se da usando la referencia de que la entalpía específica de agua es cero a 0.01 ° C y presión atmosférica normal , donde h L = 0.00 kJ / kg . Sin embargo, el hecho de que se desconozca el valor absoluto de la entalpía específica no es un problema, porque es el cambio en la entalpía específica (∆h) y no el valor absoluto lo que es importante en los problemas prácticos.
Fórmulas para entalpía específica de vapor húmedo
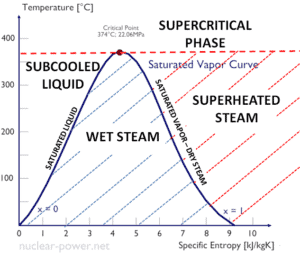 La entalpía específica de agua líquida saturada (x = 0) y vapor seco (x = 1) se puede recoger de las mesas de vapor. En caso de vapor húmedo , la entalpía real se puede calcular con la calidad del vapor, x , y las entalpías específicas de agua líquida saturada y vapor seco:
La entalpía específica de agua líquida saturada (x = 0) y vapor seco (x = 1) se puede recoger de las mesas de vapor. En caso de vapor húmedo , la entalpía real se puede calcular con la calidad del vapor, x , y las entalpías específicas de agua líquida saturada y vapor seco:
h húmedo = h s x + (1 – x) h l
dónde
h húmedo = entalpía de vapor húmedo (J / kg)
h s = entalpía de vapor “seco” (J / kg)
h l = entalpía de agua líquida saturada (J / kg)
Como se puede ver, el vapor húmedo siempre tendrá una entalpía más baja que el vapor seco.
Ejemplo:
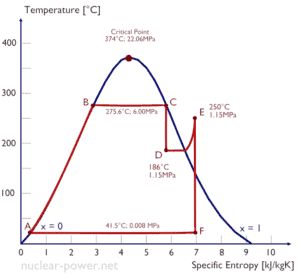
Una etapa de alta presión de la turbina de vapor funciona en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto C). El vapor sale de esta etapa de la turbina a una presión de 1,15 MPa, 186 ° C yx = 0,87 (punto D). Calcule la diferencia de entalpía entre estos dos estados.
La entalpía para el estado C puede seleccionarse directamente de las tablas de vapor, mientras que la entalpía para el estado D debe calcularse utilizando la calidad del vapor:
h 1, húmedo = 2785 kJ / kg
h 2, húmedo = h 2, s x + (1 – x) h 2, l = 2782. 0.87 + (1 – 0.87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.