Entalpía en Unidades Intensivas – Entalpía Específica
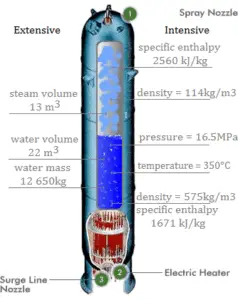
La entalpía se puede convertir en una variable intensiva o específica dividiéndola por la masa . Los ingenieros usan la entalpía específica en el análisis termodinámico más que la entalpía misma. La entalpía específica (h) de una sustancia es su entalpía por unidad de masa. Es igual a la entalpía total (H) dividida por la masa total (m).
h = H / m
dónde:
h = entalpía específica (J / kg)
H = entalpía (J)
m = masa (kg)
Tenga en cuenta que la entalpía es la cantidad termodinámica equivalente al contenido total de calor de un sistema. La entalpía específica es igual a la energía interna específica del sistema más el producto de presión y volumen específico .
h = u + pv
En general, la entalpía es una propiedad de una sustancia , como la presión, la temperatura y el volumen, pero no se puede medir directamente. Normalmente, la entalpía de una sustancia se da con respecto a algún valor de referencia. Por ejemplo, la entalpía específica de agua o vapor se da utilizando la referencia de que la entalpía específica de agua es cero a 0.01 ° C y presión atmosférica normal , donde h L = 0.00 kJ / kg . Sin embargo, el hecho de que se desconozca el valor absoluto de la entalpía específica no es un problema, porque es el cambio en la entalpía específica (∆h) y no el valor absoluto lo que es importante en los problemas prácticos.
Ver también: Tablas de vapor
Entalpía de vaporización
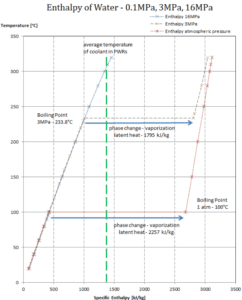
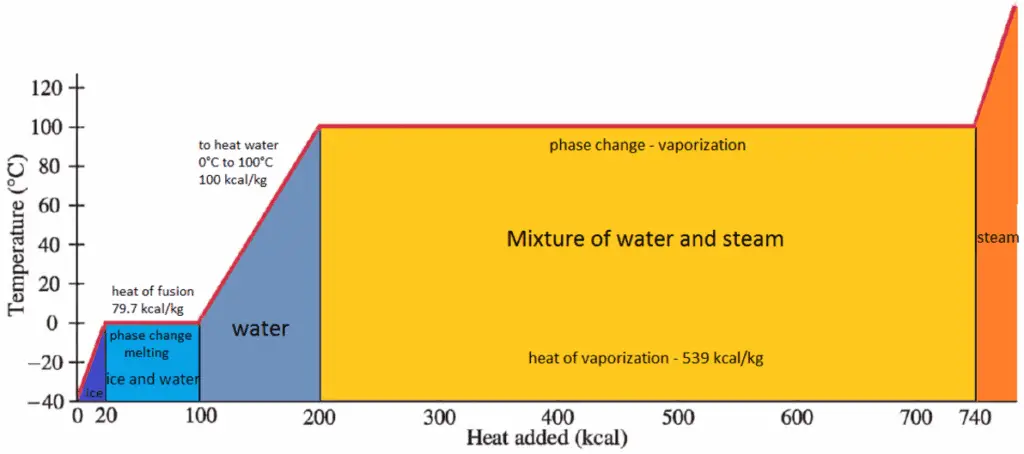
En general, cuando un material cambia de fase de sólido a líquido, o de líquido a gas, una cierta cantidad de energía está involucrada en este cambio de fase. En caso de cambio de fase de líquido a gas, esta cantidad de energía se conoce como entalpía de vaporización , (símbolo ∆H vap ; unidad: J) también conocido como calor (latente) de vaporización o calor de evaporación. El calor latente es la cantidad de calor agregado o eliminado de una sustancia para producir un cambio de fase. Esta energía descompone las fuerzas de atracción intermoleculares, y también debe proporcionar la energía necesaria para expandir el gas (el trabajo pΔV) Cuando se agrega calor latente, no ocurre cambio de temperatura. La entalpía de la vaporización es una función de la presión a la que tiene lugar esa transformación.
Calor latente de vaporización – agua a 0.1 MPa (presión atmosférica)
h lg = 2257 kJ / kg
Calor latente de vaporización: agua a 3 MPa (presión dentro de un generador de vapor)
h lg = 1795 kJ / kg
Calor latente de vaporización: agua a 16 MPa (presión dentro de un presurizador )
h lg = 931 kJ / kg
El calor de vaporización disminuye al aumentar la presión, mientras que aumenta el punto de ebullición . Se desvanece por completo en un cierto punto llamado punto crítico . Por encima del punto crítico, las fases líquida y de vapor son indistinguibles, y la sustancia se llama fluido supercrítico .
El calor de vaporización es el calor requerido para vaporizar completamente una unidad de líquido saturado (o condensar una unidad de masa de vapor saturado) y es igual a h lg = h g – h l .
El calor necesario para derretir (o congelar) una unidad de masa en la sustancia a presión constante es el calor de fusión y es igual a h sl = h l – h s , donde h s es la entalpía del sólido saturado y h l Es la entalpía del líquido saturado.
Entalpía específica de vapor húmedo
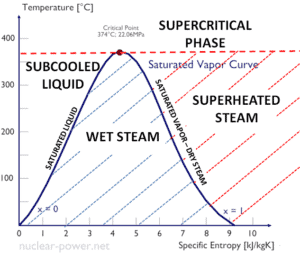 La entalpía específica de agua líquida saturada (x = 0) y vapor seco (x = 1) se puede recoger de las mesas de vapor. En caso de vapor húmedo , la entalpía real se puede calcular con la calidad del vapor, x , y las entalpías específicas de agua líquida saturada y vapor seco:
La entalpía específica de agua líquida saturada (x = 0) y vapor seco (x = 1) se puede recoger de las mesas de vapor. En caso de vapor húmedo , la entalpía real se puede calcular con la calidad del vapor, x , y las entalpías específicas de agua líquida saturada y vapor seco:
h húmedo = h s x + (1 – x) h l
dónde
h húmedo = entalpía de vapor húmedo (J / kg)
h s = entalpía de vapor “seco” (J / kg)
h l = entalpía de agua líquida saturada (J / kg)
Como se puede ver, el vapor húmedo siempre tendrá una entalpía más baja que el vapor seco.
Ejemplo:
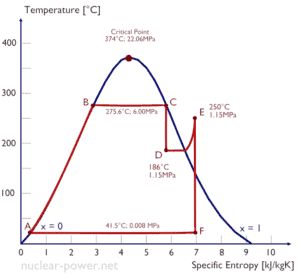
Una etapa de alta presión de la turbina de vapor funciona en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto C). El vapor sale de esta etapa de la turbina a una presión de 1,15 MPa, 186 ° C yx = 0,87 (punto D). Calcule la diferencia de entalpía entre estos dos estados.
La entalpía para el estado C puede seleccionarse directamente de las tablas de vapor, mientras que la entalpía para el estado D debe calcularse utilizando la calidad del vapor:
h 1, húmedo = 2785 kJ / kg
h 2, húmedo = h 2, s x + (1 – x) h 2, l = 2782. 0.87 + (1 – 0.87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.