Enthalpieformeln in umfangreichen Einheiten
H = U + pV
Die Enthalpie ist eine große Menge, sie hängt von der Größe des Systems oder von der Menge der darin enthaltenen Substanz ab. Die SI-Einheit der Enthalpie ist das Joule (J). Es ist die im System enthaltene Energie, ohne die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Gesamtsystems aufgrund externer Kraftfelder. Dies ist die thermodynamische Größe, die dem gesamten Wärmeinhalt eines Systems entspricht.
Andererseits kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Diese Energiespeicherung auf atomarer Ebene schließt Energie ein, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Die Enthalpie wird durch das Symbol H dargestellt , und die Änderung der Enthalpie in einem Prozess ist H 2 – H 1 .
Es gibt Enthalpieformeln für bekanntere Variablen wie Temperatur und Druck :
dH = C p dT + V (1 & agr; T-) dp
Dabei ist C p die Wärmekapazität bei konstantem Druck und α der (kubische) Wärmeausdehnungskoeffizient. Für ideales Gas αT = 1 und damit:
dH = C p dT
Enthalpieformeln in intensiven Einheiten – Spezifische Enthalpie
Die Enthalpie kann durch Teilen durch die Masse zu einer intensiven oder spezifischen Variablen gemacht werden . Ingenieure verwenden die spezifische Enthalpie in der thermodynamischen Analyse mehr als die Enthalpie selbst. Die spezifische Enthalpie (h) eines Stoffes ist seine Enthalpie pro Masseneinheit. Sie entspricht der Gesamtenthalpie (H) geteilt durch die Gesamtmasse (m).
h = H / m
wo:
h = spezifische Enthalpie (J / kg)
H = Enthalpie (J)
m = Masse (kg)
Beachten Sie, dass die Enthalpie die thermodynamische Größe ist, die dem Gesamtwärmegehalt eines Systems entspricht. Die spezifische Enthalpie entspricht der spezifischen inneren Energie des Systems plus dem Produkt aus Druck und spezifischem Volumen .
h = u + pv
Im Allgemeinen ist die Enthalpie eine Eigenschaft einer Substanz wie Druck, Temperatur und Volumen, kann jedoch nicht direkt gemessen werden. Normalerweise wird die Enthalpie eines Stoffes in Bezug auf einen Referenzwert angegeben. Zum Beispiel wird die spezifische Enthalpie von Wasser oder Dampf unter Verwendung der Referenz angegeben, dass die spezifische Enthalpie von Wasser bei 0,01 ° C und normalem atmosphärischem Druck Null ist , wobei h L = 0,00 kJ / kg ist . Die Tatsache, dass der Absolutwert der spezifischen Enthalpie unbekannt ist, ist jedoch kein Problem, da bei praktischen Problemen die Änderung der spezifischen Enthalpie (∆h) und nicht der Absolutwert wichtig ist.
Formeln für die spezifische Enthalpie von Nassdampf
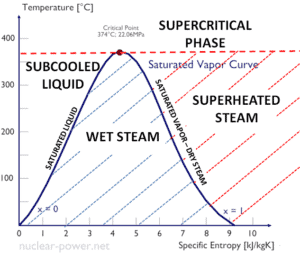 Die spezifische Enthalpie von gesättigtem flüssigem Wasser (x = 0) und trockenem Dampf (x = 1) kann aus Dampftabellen entnommen werden. Im Fall von Naßdampf kann die tatsächliche Enthalpie mit der berechnen Dampfqualität x , und den spezifischen Enthalpien gesättigten flüssigen Wasser und Trockendampf:
Die spezifische Enthalpie von gesättigtem flüssigem Wasser (x = 0) und trockenem Dampf (x = 1) kann aus Dampftabellen entnommen werden. Im Fall von Naßdampf kann die tatsächliche Enthalpie mit der berechnen Dampfqualität x , und den spezifischen Enthalpien gesättigten flüssigen Wasser und Trockendampf:
h nass = h s x + (1 – x) h l
wo
h nass = Enthalpie des feuchten Dampfes (J / kg)
h s = Enthalpie von “trockenem” Dampf (J / kg)
h l = Enthalpie von gesättigtem flüssigem Wasser (J / kg)
Wie zu sehen ist, hat nasser Dampf immer eine geringere Enthalpie als trockener Dampf.
Beispiel:
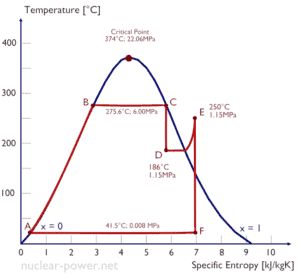
Eine Hochdruckstufe der Dampfturbine arbeitet im stationären Zustand mit Einlassbedingungen von 6 MPa, t = 275,6 ° C, x = 1 (Punkt C). Dampf verlässt diese Turbinenstufe mit einem Druck von 1,15 MPa, 186 ° C und x = 0,87 (Punkt D). Berechnen Sie die Enthalpiedifferenz zwischen diesen beiden Zuständen.
Die Enthalpie für den Zustand C kann direkt aus Dampftabellen entnommen werden, während die Enthalpie für den Zustand D anhand der Dampfqualität berechnet werden muss:
h 1, nass = 2785 kJ / kg
h 2, nass = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.