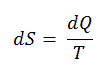¿Qué es la entropía?
En termodinámica y física estadística, la entropía es una medida cuantitativa del desorden, o de la energía en un sistema para hacer el trabajo.En física estadística, la entropía es una medida del desorden de un sistema. A lo que se refiere el trastorno es realmente la cantidad de configuraciones microscópicas , W , que puede tener un sistema termodinámico cuando está en un estado especificado por ciertas variables macroscópicas ( volumen , energía , presión y temperatura ). Por “estados microscópicos”, nos referimos a los estados exactos de todas las moléculas que componen el sistema.
Matemáticamente, la definición exacta es:
Entropía = (constante de Boltzmann k) x logaritmo del número de estados posibles
S = k B logW
Esta ecuación, que relaciona los detalles microscópicos, o microestados, del sistema (a través de W ) con su estado macroscópico (a través de la entropía S ), es la idea clave de la mecánica estadística. En un sistema cerrado, la entropía nunca disminuye, por lo que en el Universo la entropía aumenta irreversiblemente. En un sistema abierto (por ejemplo, un árbol en crecimiento), la entropía puede disminuir y el orden puede aumentar, pero solo a expensas de un aumento de la entropía en otro lugar (por ejemplo, en el Sol).
La entropía está aumentando.
Unidades de entropía
El SI unidad para la entropía es J / K . Según Clausius, la entropía se definió mediante el cambio en la entropía S de un sistema. El cambio en la entropía S, cuando se le agrega una cantidad de calor Q mediante un proceso reversible a temperatura constante, viene dado por:
Aquí Q es la energía transferida como calor hacia o desde el sistema durante el proceso, y T es la temperatura del sistema en grados Kelvin durante el proceso. Si suponemos un proceso isotérmico reversible , el cambio de entropía total viene dado por:
∆S = S 2 – S 1 = Q / T
En esta ecuación, el cociente Q / T está relacionado con el aumento del desorden. Mayor temperatura significa mayor aleatoriedad de movimiento. A temperaturas más bajas, la adición de calor Q provoca un aumento fraccional sustancial en el movimiento molecular y la aleatoriedad. Por otro lado, si la sustancia ya está caliente, la misma cantidad de calor Q agrega relativamente poco al mayor movimiento molecular.
Ejemplo: cambio de entropía en el hielo derretido
Calcule el cambio en la entropía de 1 kg de hielo a 0 ° C, cuando se derrite reversiblemente en agua a 0 ° C.
Dado que es un proceso isotérmico, podemos usar:
∆S = S 2 – S 1 = Q / T
por lo tanto, el cambio de entropía será:
∆S = 334 [kJ] / 273.15 [K] = 1.22 [kJ / K]
donde se requieren 334 kilojulios de calor para derretir 1 kg de hielo (calor de fusión latente = 334 kJ / kg) y este calor se transfiere al sistema a 0 ° C (273,15 K).
Entropía Específica
La entropía se puede convertir en una variable intensiva o específica dividiéndola por la masa. Los ingenieros usan la entropía específica en el análisis termodinámico más que la entropía misma. La entropía específica (s) de una sustancia es su entropía por unidad de masa. Es igual a la entropía total (S) dividida por la masa total (m).
s = S / m
dónde:
s = entropía específica (J / kg)
S = entropía (J)
m = masa (kg)
La entropía cuantifica la energía de una sustancia que ya no está disponible para realizar un trabajo útil. Debido a que la entropía dice mucho acerca de la utilidad de una cantidad de calor transferida en la realización del trabajo, las tablas de vapor incluyen valores de entropía específica (s = S / m) como parte de la información tabulada.
En general, la entropía específica es una propiedad de una sustancia, como la presión, la temperatura y el volumen, pero no se puede medir directamente. Normalmente, la entropía de una sustancia se da con respecto a algún valor de referencia. Por ejemplo, la entropía específica de agua o vapor se da usando la referencia de que la entropía específica del agua es cero a 0.01 ° C y presión atmosférica normal , donde s = 0.00 kJ / kg. Sin embargo, el hecho de que se desconozca el valor absoluto de la entropía específica no es un problema, porque es el cambio en la entropía específica (∆s) y no el valor absoluto lo que es importante en los problemas prácticos.
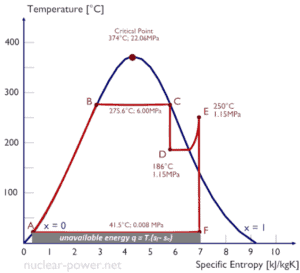
Diagramas de temperatura-entropía – Diagramas Ts
En general, las fases de una sustancia y las relaciones entre sus propiedades se muestran más comúnmente en los diagramas de propiedades . Se ha definido una gran cantidad de propiedades diferentes y existen algunas dependencias entre las propiedades.
Un diagrama de temperatura-entropía ( diagrama Ts ) es el tipo de diagrama más utilizado para analizar los ciclos del sistema de transferencia de energía. Se utiliza en termodinámica para visualizar cambios en la temperatura y entropía específica durante un proceso o ciclo termodinámico.
Esto se debe a que el trabajo realizado por o en el sistema y el calor agregado o eliminado del sistema se pueden visualizar en el diagrama Ts . Según la definición de entropía, el calor transferido hacia o desde un sistema es igual al área bajo la curva Ts del proceso.
dQ = TdS
Un proceso isentrópico se representa como una línea vertical en un diagrama Ts, mientras que un proceso isotérmico es una línea horizontal. En un estado idealizado, la compresión es una bomba, la compresión en un compresor y la expansión en una turbina son procesos isoentrópicos. Por lo tanto, es muy útil en ingeniería de energía, porque estos dispositivos se usan en ciclos termodinámicos de plantas de energía.
Tenga en cuenta que los supuestos isentrópicos solo son aplicables con ciclos ideales. Los ciclos termodinámicos reales tienen pérdidas de energía inherentes debido a la ineficiencia de los compresores y las turbinas.
Irreversibilidad de los procesos naturales.
Según la segunda ley de la termodinámica:
La entropía de cualquier sistema aislado nunca disminuye. En un proceso termodinámico natural, aumenta la suma de las entropías de los sistemas termodinámicos que interactúan.
Esta ley indica la irreversibilidad de los procesos naturales . Los procesos reversibles son una ficción teórica útil y conveniente, pero no ocurren en la naturaleza. De esta ley se deduce que es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente. De ello se deduce que las máquinas de movimiento perpetuo del segundo tipo son imposibles.
Entropía en el cero absoluto
Según la tercera ley de la termodinámica:
La entropía de un sistema se aproxima a un valor constante a medida que la temperatura se acerca al cero absoluto.
Basado en evidencia empírica, esta ley establece que la entropía de una sustancia cristalina pura es cero en el cero absoluto de temperatura , 0 K y que es imposible mediante cualquier proceso, sin importar cuán idealizado esté, reducir la temperatura de un sistema a cero absoluto en un número finito de pasos. Esto nos permite definir un punto cero para la energía térmica de un cuerpo.
El cero absoluto es la temperatura teórica más fría, a la cual el movimiento térmico de los átomos y las moléculas alcanza su mínimo. Este es un estado en el que la entalpía y la entropía de un gas ideal enfriado alcanza su valor mínimo, tomado como 0. Clásicamente , este sería un estado de inmovilidad , pero la incertidumbre cuántica dicta que las partículas aún poseen una energía finita de punto cero . El cero absoluto se denota como 0 K en la escala Kelvin, −273.15 ° C en la escala Celsius y −459.67 ° F en la escala Fahrenheit.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.