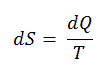Unités d’entropie
L’IS unité pour l’ entropie est J / K . Selon Clausius, l’entropie était définie via le changement d’entropie S d’un système. Le changement d’entropie S, quand une quantité de chaleur Q lui est ajoutée par un processus réversible à température constante, est donné par:
Ici, Q représente l’ énergie transférée sous forme de chaleur vers ou depuis le système au cours du processus et T la température du système en kelvins au cours du processus. Si nous supposons un processus isothermique réversible , le changement d’entropie total est donné par:
∆S = S 2 – S 1 = Q / T
Dans cette équation, le quotient Q / T est lié à l’augmentation du désordre. Plus la température est élevée, plus le mouvement est aléatoire. À des températures plus basses, l’ajout de chaleur Q provoque une augmentation fractionnelle substantielle du mouvement moléculaire et du caractère aléatoire. D’autre part, si la substance est déjà chaude, la même quantité de chaleur Q ajoute relativement peu au mouvement moléculaire supérieur.
Exemple: changement d’entropie dans la glace fondante
Calculez le changement d’entropie de 1 kg de glace à 0 ° C, une fois fondue de manière réversible en eau à 0 ° C.
Comme il s’agit d’un processus isothermique, on peut utiliser:
∆S = S 2 – S 1 = Q / T
donc le changement d’entropie sera:
∆S = 334 [kJ] / 273,15 [K] = 1,22 [kJ / K]
où il faut 334 kilojoules de chaleur pour faire fondre 1 kg de glace (chaleur de fusion latente = 334 kJ / kg) et que cette chaleur est transférée dans le système à 0 ° C (273,15 K).
Entropie spécifique
L’entropie peut être transformée en une variable intensive ou spécifique , en la divisant par la masse. Les ingénieurs utilisent plus l’entropie spécifique dans l’analyse thermodynamique que l’entropie elle-même. L’entropie spécifique d’une substance est son entropie par unité de masse. Elle est égale à l’entropie totale (S) divisée par la masse totale (m).
s = S / m
où:
s = entropie spécifique (J / kg)
S = entropie (J)
m = masse (kg)
L’entropie quantifie l’énergie d’une substance qui n’est plus disponible pour effectuer un travail utile. Étant donné que l’entropie en dit long sur l’utilité d’une quantité de chaleur transférée dans l’exécution des travaux, les tables de vapeur incluent des valeurs d’ entropie spécifique (s = S / m) dans le cadre des informations tabulées.
En général, l’entropie spécifique est une propriété d’une substance, comme la pression, la température et le volume, mais elle ne peut pas être mesurée directement. Normalement, l’entropie d’une substance est donnée par rapport à une valeur de référence. Par exemple, l’entropie spécifique de l’eau ou de la vapeur est donnée en utilisant la référence que l’ entropie spécifique de l’eau est nulle à 0,01 ° C et à la pression atmosphérique normale , où s = 0,00 kJ / kg. Le fait que la valeur absolue de l’entropie spécifique soit inconnue ne pose cependant pas de problème, car c’est le changement d’entropie spécifique ((s) et non la valeur absolue qui est important dans les problèmes pratiques.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci