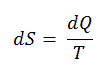Qu’est-ce que l’entropie
Mathématiquement, la définition exacte est:
Entropie = (constante de Boltzmann k) x logarithme du nombre d’états possibles
S = k B logW
Cette équation, qui relie les détails microscopiques, ou microstats, du système (via W ) à son état macroscopique (via l’ entropie S ), est l’idée clé de la mécanique statistique. Dans un système fermé, l’entropie ne diminue jamais, donc dans l’Univers l’entropie augmente irréversiblement. Dans un système ouvert (par exemple, un arbre en croissance), l’entropie peut diminuer et l’ordre peut augmenter, mais seulement au détriment d’une augmentation de l’entropie ailleurs (par exemple au Soleil).
L’entropie augmente.
Unités d’entropie
L’IS unité pour l’ entropie est J / K . Selon Clausius, l’entropie a été définie via le changement d’entropie S d’un système. L’évolution de l’entropie S, lorsqu’une quantité de chaleur Q lui est ajoutée par un processus réversible à température constante, est donnée par:
Ici Q est l’ énergie transférée sous forme de chaleur vers ou depuis le système pendant le processus, et T est la température du système en kelvins pendant le processus. Si nous supposons un processus isotherme réversible , le changement d’entropie total est donné par:
∆S = S 2 – S 1 = Q / T
Dans cette équation, le quotient Q / T est lié à l’augmentation du désordre. Une température plus élevée signifie un plus grand caractère aléatoire du mouvement. À des températures plus basses, l’ajout de chaleur Q provoque une augmentation fractionnelle substantielle du mouvement moléculaire et de l’aléatoire. En revanche, si la substance est déjà chaude, la même quantité de chaleur Q ajoute relativement peu au plus grand mouvement moléculaire.
Exemple: changement d’entropie dans la fonte des glaces
Calculez le changement d’entropie de 1 kg de glace à 0 ° C, lorsqu’elle est fondue de manière réversible dans de l’eau à 0 ° C.
Puisqu’il s’agit d’un processus isotherme, nous pouvons utiliser:
∆S = S 2 – S 1 = Q / T
par conséquent, le changement d’entropie sera:
∆S = 334 [kJ] / 273,15 [K] = 1,22 [kJ / K]
où 334 kilojoules de chaleur sont nécessaires pour faire fondre 1 kg de glace (chaleur latente de fusion = 334 kJ / kg) et cette chaleur est transférée au système à 0 ° C (273,15 K).
Entropie spécifique
L’entropie peut être transformée en une variable intensive ou spécifique , en la divisant par la masse. Les ingénieurs utilisent plus l’entropie spécifique dans l’analyse thermodynamique que l’entropie elle-même. L’entropie spécifique d’une substance est son entropie par unité de masse. Elle est égale à l’entropie totale (S) divisée par la masse totale (m).
s = S / m
où:
s = entropie spécifique (J / kg)
S = entropie (J)
m = masse (kg)
L’entropie quantifie l’énergie d’une substance qui n’est plus disponible pour effectuer un travail utile. Étant donné que l’entropie en dit long sur l’utilité d’une quantité de chaleur transférée dans l’exécution des travaux, les tables de vapeur incluent des valeurs d’ entropie spécifique (s = S / m) dans le cadre des informations tabulées.
En général, l’entropie spécifique est une propriété d’une substance, comme la pression, la température et le volume, mais elle ne peut pas être mesurée directement. Normalement, l’entropie d’une substance est donnée par rapport à une valeur de référence. Par exemple, l’entropie spécifique de l’eau ou de la vapeur est donnée en utilisant la référence que l’ entropie spécifique de l’eau est nulle à 0,01 ° C et à la pression atmosphérique normale , où s = 0,00 kJ / kg. Le fait que la valeur absolue de l’entropie spécifique soit inconnue ne pose cependant pas de problème, car c’est le changement d’entropie spécifique ((s) et non la valeur absolue qui est important dans les problèmes pratiques.
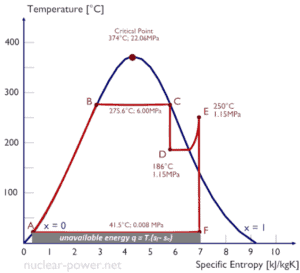
Diagrammes température-entropie – Diagrammes Ts
En général, les phases d’une substance et les relations entre ses propriétés sont le plus souvent représentées sur les diagrammes de propriétés . Un grand nombre de propriétés différentes ont été définies et il existe des dépendances entre les propriétés.
Un diagramme température-entropie ( diagramme Ts ) est le type de diagramme le plus fréquemment utilisé pour analyser les cycles du système de transfert d’énergie. Il est utilisé en thermodynamique pour visualiser les changements de température et l’entropie spécifique au cours d’un processus ou cycle thermodynamique.
En effet, le travail effectué par ou sur le système et la chaleur ajoutée ou retirée du système peuvent être visualisés sur le diagramme Ts . Par la définition de l’entropie, la chaleur transférée vers ou depuis un système est égale à l’ aire sous la courbe Ts du processus.
dQ = TdS
Un processus isentropique est représenté comme une ligne verticale sur un diagramme Ts, tandis qu’un processus isotherme est une ligne horizontale. Dans un état idéalisé, la compression est une pompe, la compression dans un compresseur et l’expansion dans une turbine sont des processus isentropiques. Par conséquent, il est très utile en génie électrique, car ces appareils sont utilisés dans les cycles thermodynamiques des centrales électriques.
Notez que les hypothèses isentropiques ne sont applicables qu’avec des cycles idéaux. Les cycles thermodynamiques réels ont des pertes d’énergie inhérentes dues à l’inefficacité des compresseurs et des turbines.
Irréversibilité des processus naturels
Selon le deuxième principe de la thermodynamique:
L’entropie de tout système isolé ne diminue jamais. Dans un processus thermodynamique naturel, la somme des entropies des systèmes thermodynamiques en interaction augmente.
Cette loi indique l’ irréversibilité des processus naturels . Les processus réversibles sont une fiction théorique utile et pratique, mais ne se produisent pas dans la nature. De cette loi découle qu’il est impossible de construire un dispositif qui fonctionne sur un cycle et dont le seul effet est le transfert de chaleur d’un corps plus froid vers un corps plus chaud. Il s’ensuit que les machines à mouvement perpétuel du deuxième type sont impossibles.
Entropie à Absolute Zero
Selon le troisième principe de la thermodynamique:
L’entropie d’un système se rapproche d’une valeur constante lorsque la température approche du zéro absolu.
Sur la base de preuves empiriques, cette loi stipule que l’ entropie d’une substance cristalline pure est nulle au zéro absolu de la température , 0 K et qu’il est impossible, par quelque procédé que ce soit, idéalisé, de réduire la température d’un système au zéro absolu en un nombre fini d’étapes. Cela nous permet de définir un point zéro pour l’énergie thermique d’un corps.
Le zéro absolu est la température théorique la plus froide, à laquelle le mouvement thermique des atomes et des molécules atteint son minimum. Il s’agit d’un état dans lequel l’enthalpie et l’entropie d’un gaz parfait refroidi atteint sa valeur minimale, prise à 0. Classiquement , ce serait un état d’ immobilité , mais l’ incertitude quantique dicte que les particules possèdent toujours une énergie finie au point zéro . Le zéro absolu est noté 0 K sur l’échelle Kelvin, −273,15 ° C sur l’échelle Celsius et −459,67 ° F sur l’échelle Fahrenheit.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci