 Para a condensação, os efeitos de calor latente associados à mudança de fase são significativos, da mesma forma que na fervura, mas ao contrário. Observe que a entalpia da condensação (ou calor da condensação ) é por definição igual à entalpia da vaporização com o sinal oposto. Calor latente é a quantidade de calor adicionada ou removida de uma substância para produzir uma mudança de fase. Durante a vaporização, essa energia decompõe as forças atrativas intermoleculares e também deve fornecer a energia necessária para expandir o gás (o trabalho pΔV ). Quando o calor latente é adicionado ou removido, nenhuma mudança de temperatura ocorre. A entalpia da vaporização é uma função da pressão na qual essa transformação ocorre.
Para a condensação, os efeitos de calor latente associados à mudança de fase são significativos, da mesma forma que na fervura, mas ao contrário. Observe que a entalpia da condensação (ou calor da condensação ) é por definição igual à entalpia da vaporização com o sinal oposto. Calor latente é a quantidade de calor adicionada ou removida de uma substância para produzir uma mudança de fase. Durante a vaporização, essa energia decompõe as forças atrativas intermoleculares e também deve fornecer a energia necessária para expandir o gás (o trabalho pΔV ). Quando o calor latente é adicionado ou removido, nenhuma mudança de temperatura ocorre. A entalpia da vaporização é uma função da pressão na qual essa transformação ocorre.
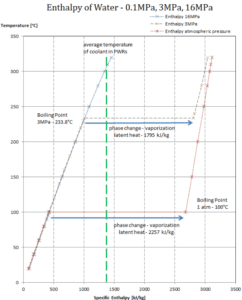
Calor latente de condensação – água a 0,1 MPa (pressão atmosférica)
h lg = – 2257 kJ / kg
Calor latente de condensação – água a 3 MPa
h lg = – 1795 kJ / kg
Calor latente de condensação – água a 16 MPa (pressão dentro de um pressurizador )
h lg = – 931 kJ / kg
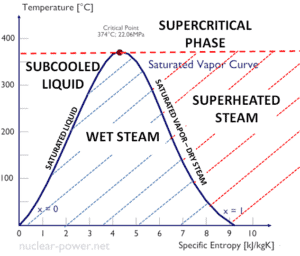
O calor da condensação diminui com o aumento da pressão, enquanto o ponto de ebulição aumenta. Ele desaparece completamente em um determinado ponto chamado ponto crítico . Acima do ponto crítico, as fases líquida e de vapor são indistinguíveis, e a substância é chamada de fluido supercrítico .
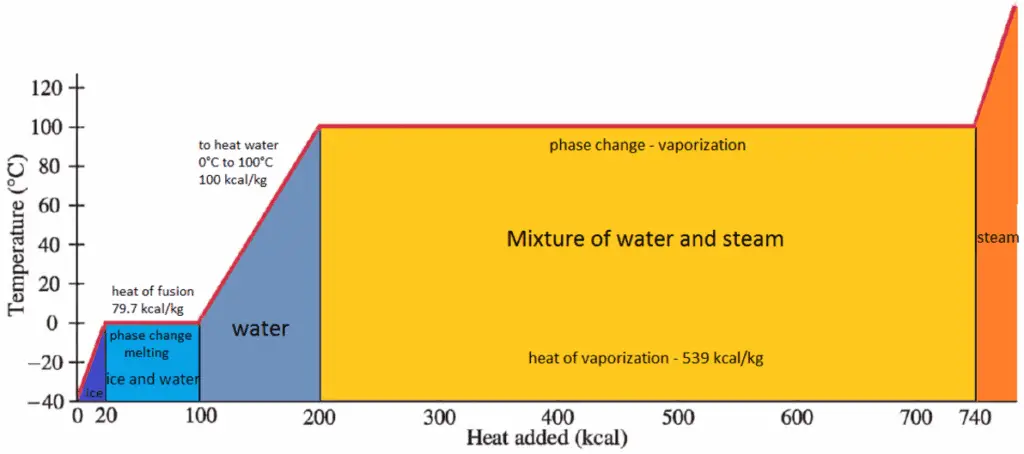
O calor da condensação é o calor liberado para condensar completamente uma unidade de vapor saturado e é igual a – h lg = h l – h g .
O calor necessário para derreter (ou congelar) uma unidade de massa na substância a pressão constante é o calor da fusão e é igual a h sl = h l – h s , onde h s é a entalpia do sólido saturado e h l é a entalpia do líquido saturado.
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.