Calor latente de vaporização
Em geral, quando um material muda de fase de sólido para líquido, ou de líquido para gás, uma certa quantidade de energia está envolvida nessa mudança de fase. No caso de mudança de fase de líquido para gás, essa quantidade de energia é conhecida como entalpia de vaporização (símbolo ∆H vap ; unidade: J), também conhecida como calor (latente) de vaporização ou calor de evaporação. Calor latente é a quantidade de calor adicionada ou removida de uma substância para produzir uma mudança de fase. Essa energia decompõe as forças atraentes intermoleculares e também deve fornecer a energia necessária para expandir o gás (o trabalho pΔV) Quando o calor latente é adicionado, nenhuma mudança de temperatura ocorre. A entalpia da vaporização é uma função da pressão na qual essa transformação ocorre.
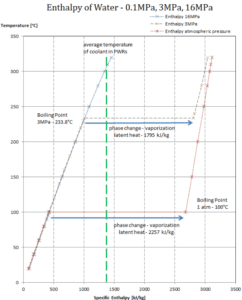
Calor latente de vaporização – água a 0,1 MPa (pressão atmosférica)
h lg = 2257 kJ / kg
Calor latente de vaporização – água a 3 MPa (pressão dentro de um gerador de vapor)
h lg = 1795 kJ / kg
Calor latente de vaporização – água a 16 MPa (pressão dentro de um pressurizador )
h lg = 931 kJ / kg
O calor da vaporização diminui com o aumento da pressão, enquanto o ponto de ebulição aumenta. Ele desaparece completamente em um determinado ponto chamado ponto crítico . Acima do ponto crítico, as fases líquida e de vapor são indistinguíveis, e a substância é chamada de fluido supercrítico .
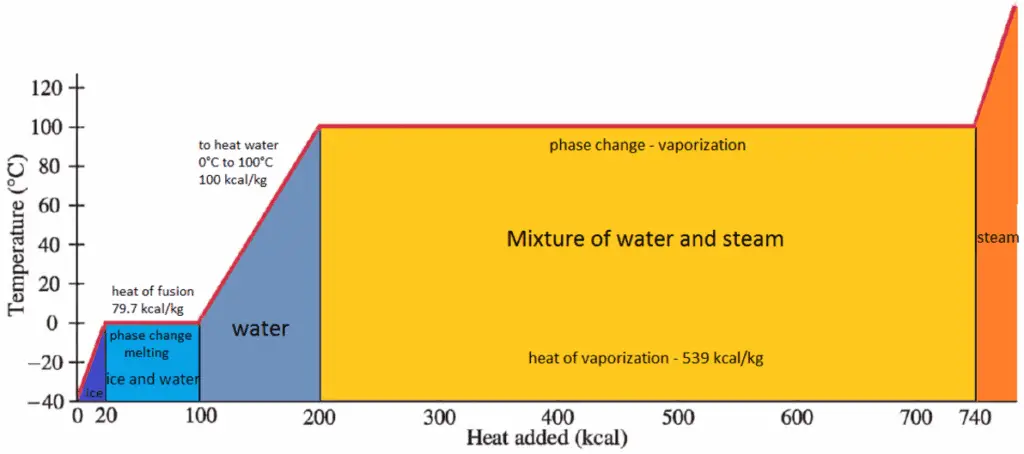
O calor da vaporização é o calor necessário para vaporizar completamente uma unidade de líquido saturado (ou condensar uma unidade de massa de vapor saturado) e é igual a h lg = h g – h l .
O calor necessário para derreter (ou congelar) uma unidade de massa na substância a pressão constante é o calor da fusão e é igual a h sl = h l – h s , onde h s é a entalpia do sólido saturado e h l é a entalpia do líquido saturado.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.