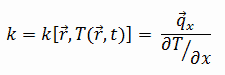Energia Térmica – Definição
Energia Térmica – Definição
Na termodinâmica, energia térmica (também chamada de energia interna ) é definida como a energia associada a formas microscópicas de energia . É uma quantidade extensa , depende do tamanho do sistema ou da quantidade de substância que ele contém. A unidade SI de energia térmica é o joule (J) . É a energia contida no sistema, excluindo a energia cinética do movimento do sistema como um todo e a energia potencial do sistema. As formas microscópicas de energia incluem aquelas devidas à rotação , vibração, translação e interações entre as moléculas de uma substância. Nenhuma dessas formas de energia pode ser medida ou avaliada diretamente, mas técnicas foram desenvolvidas para avaliar a mudança na soma total de todas essas formas microscópicas de energia.
Energia microscópica
Energia Térmica – Definição
A energia interna envolve energia na escala microscópica . Pode ser dividido em energia microscópica potencial, pote U e energia cinética microscópica, U kin , componentes:
U = U pote + U parentes
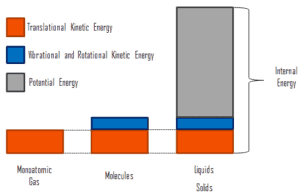 onde a energia cinética microscópica, U kin , envolve os movimentos de todas as partículas do sistema em relação à estrutura do centro de massa. Para um gás monatômico ideal , essa é apenas a energia cinética translacional do movimento linear dos átomos. Partículas monoatômicas não giram ou vibram. O comportamento do sistema é bem descrito pela teoria cinética dos gases. A teoria cinética baseia-se no fato de que durante uma colisão elástica entre uma molécula com alta energia cinética e outra com baixa energia cinética, parte da energia será transferida para a molécula de energia cinética inferior. No entanto, para gases poliatômicos, existem rotações eenergia cinética vibracional também.
onde a energia cinética microscópica, U kin , envolve os movimentos de todas as partículas do sistema em relação à estrutura do centro de massa. Para um gás monatômico ideal , essa é apenas a energia cinética translacional do movimento linear dos átomos. Partículas monoatômicas não giram ou vibram. O comportamento do sistema é bem descrito pela teoria cinética dos gases. A teoria cinética baseia-se no fato de que durante uma colisão elástica entre uma molécula com alta energia cinética e outra com baixa energia cinética, parte da energia será transferida para a molécula de energia cinética inferior. No entanto, para gases poliatômicos, existem rotações eenergia cinética vibracional também.
A energia potencial microscópica, U pot , envolve as ligações químicas entre os átomos que compõem as moléculas, as forças de ligação no núcleo e também os campos de força física no sistema (por exemplo, campos elétricos ou magnéticos).
Em líquidos e sólidos, há um componente significativo da energia potencial associada às forças de atração intermoleculares .
Energia térmica e calor
 Enquanto energia térmica se refere à energia total de todas as moléculas dentro do objeto, o calor é a quantidade de energia que flui de um corpo para outro espontaneamente devido à diferença de temperatura. O calor é uma forma de energia, mas é energia em trânsito . O calor não é propriedade de um sistema. No entanto, a transferência de energia como calor ocorre no nível molecular como resultado de uma diferença de temperatura .
Enquanto energia térmica se refere à energia total de todas as moléculas dentro do objeto, o calor é a quantidade de energia que flui de um corpo para outro espontaneamente devido à diferença de temperatura. O calor é uma forma de energia, mas é energia em trânsito . O calor não é propriedade de um sistema. No entanto, a transferência de energia como calor ocorre no nível molecular como resultado de uma diferença de temperatura .
Considere um bloco de metal em alta temperatura, que consiste em átomos que oscilam intensamente em torno de suas posições médias. A baixas temperaturas , os átomos continuam a oscilar, mas com menos intensidade . Se um bloco mais quente de metal é colocado em contato com um bloco mais frio, os átomos intensamente oscilantes na borda do bloco mais quente emitem sua energia cinética aos átomos menos oscilantes na borda do bloco mais frio. Nesse caso, há transferência de energia entre esses dois blocos e o calor flui do bloco mais quente para o mais frio por essas vibrações aleatórias.
Distinguindo temperatura, calor e energia térmica
Usando a teoria cinética, uma distinção clara entre essas três propriedades pode ser feita.
- A temperatura está relacionada às energias cinéticas das moléculas de um material. É a energia cinética média das moléculas individuais.
- Energia interna refere-se à energia total de todas as moléculas dentro do objeto. É uma propriedade extensa , portanto, quando dois lingotes quentes de aço com massa igual podem ter a mesma temperatura, mas dois deles têm o dobro de energia interna que um.
- Finalmente, calor é a quantidade de energia que flui de um corpo para outro espontaneamente devido à diferença de temperatura.
Deve-se adicionar, quando existe uma diferença de temperatura , o calor flui espontaneamente do sistema mais quente para o sistema mais frio . Assim, se um cubo de aço de 5 kg a 100 ° C for colocado em contato com um cubo de aço de 500 kg a 20 ° C, o calor fluirá do cubo a 300 ° C para o cubo a 20 ° C, mesmo que a energia interna do cubo de 20 ° C é muito maior porque há muito mais.
Um conceito particularmente importante é o equilíbrio termodinâmico . Em geral, quando dois objetos são colocados em contato térmico , o calor flui entre eles até que entrem em equilíbrio um com o outro.
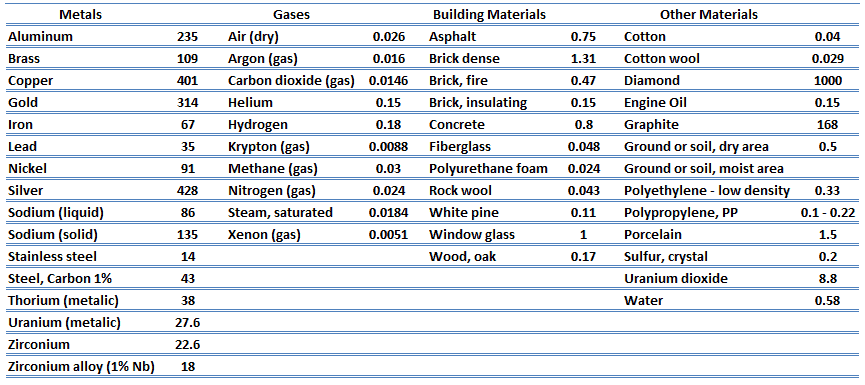
Condutividade térmica
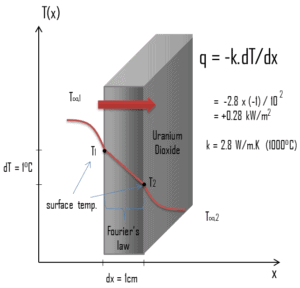 As características de transferência de calor de um material sólido são medidas por uma propriedade chamada condutividade térmica , k (ou λ), medida em W / mK . É uma medida da capacidade de uma substância de transferir calor através de um material por condução. Observe que a lei de Fourier se aplica a toda matéria, independentemente de seu estado (sólido, líquido ou gás); portanto, também é definida para líquidos e gases.
As características de transferência de calor de um material sólido são medidas por uma propriedade chamada condutividade térmica , k (ou λ), medida em W / mK . É uma medida da capacidade de uma substância de transferir calor através de um material por condução. Observe que a lei de Fourier se aplica a toda matéria, independentemente de seu estado (sólido, líquido ou gás); portanto, também é definida para líquidos e gases.
A condutividade térmica da maioria dos líquidos e sólidos varia com a temperatura. Para vapores, isso também depende da pressão. Em geral:
A maioria dos materiais é quase homogênea, portanto, geralmente podemos escrever k = k (T) . Definições semelhantes estão associadas a condutividades térmicas nas direções y e z (k y , k z ), mas para um material isotrópico a condutividade térmica é independente da direção da transferência, k x = k y = k z = k.
A partir da equação anterior, segue-se que o fluxo de calor de condução aumenta com o aumento da condutividade térmica e aumenta com o aumento da diferença de temperatura. Em geral, a condutividade térmica de um sólido é maior que a de um líquido, que é maior que a de um gás. Essa tendência se deve em grande parte às diferenças no espaçamento intermolecular para os dois estados da matéria. Em particular, o diamante tem a mais alta dureza e condutividade térmica de qualquer material a granel.
Energia Interna e a Primeira Lei da Termodinâmica
Na termodinâmica, o conceito de energia é ampliado para dar conta de outras mudanças observadas, e o princípio de conservação de energia é estendido para incluir uma ampla variedade de maneiras pelas quais os sistemas interagem com o ambiente. As únicas maneiras pelas quais a energia de um sistema fechado pode ser alterada são através da transferência de energia pelo trabalho ou pelo calor . Além disso, com base nos experimentos de Joule e outros, um aspecto fundamental do conceito de energia é que a energia é conservada. Este princípio é conhecido como a primeira lei da termodinâmica . A primeira lei da termodinâmica pode ser escrita de várias formas:
Em palavras:
Forma da equação:
IntE int = Q – W
onde E int representa a energia interna do material, que depende apenas do estado do material (temperatura, pressão e volume). Q é o calor líquido adicionado ao sistema e W é o trabalho líquido realizado pelo sistema. Devemos ser cuidadosos e consistentes ao seguir as convenções de sinal para Q e W. Como W na equação é o trabalho realizado pelo sistema, se o trabalho for feito no sistema, W será negativo e E int aumentará.
Da mesma forma, Q é positivo para o calor adicionado ao sistema; portanto, se o calor sai do sistema, Q é negativo. Isso nos diz o seguinte: A energia interna de um sistema tende a aumentar se o calor for absorvido pelo sistema ou se um trabalho positivo for feito no sistema. Por outro lado, a energia interna tende a diminuir se o calor for perdido pelo sistema ou se for feito um trabalho negativo no sistema. Deve-se adicionar Q e W dependem do caminho, enquanto E int é independente do caminho.
Forma diferencial:
dE int = dQ – dW
A energia interna E int de um sistema tende a aumentar se a energia é adicionada como calor Q e tende a diminuir se a energia é perdida como o trabalho W realizado pelo sistema.
Vide também: Sistema aberto – Sistema fechado – Sistema isolado
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.