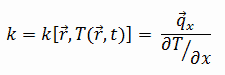Energie thermique – Définition
Energie thermique – Définition
En thermodynamique, l’ énergie thermique (aussi appelée énergie interne ) est définie comme l’ énergie associée à des formes d’énergie microscopiques . C’est une quantité considérable , cela dépend de la taille du système ou de la quantité de substance qu’il contient. L’unité SI d’ énergie thermique est le joule (J) . C’est l’énergie contenue dans le système, à l’exclusion de l’ énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système. Les formes d’énergie microscopiques incluent celles dues à la rotation , à la vibration, à la translation et aux interactions parmi les molécules d’une substance. Aucune de ces formes d’énergie ne peut être mesurée ou évaluée directement, mais des techniques ont été développées pour évaluer l’évolution de la somme totale de toutes ces formes d’énergie microscopiques.
Energie microscopique
Energie thermique – Définition
L’énergie interne implique l’énergie à l’ échelle microscopique . Il peut être divisé en énergie potentielle microscopique, en U pot , et en énergie cinétique microscopique, U kin , composants:
U = U pot + U kin
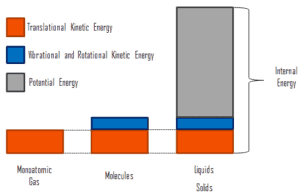 où l’énergie cinétique microscopique, U kin , implique les mouvements de toutes les particules du système par rapport au repère du centre de masse. Pour un gaz monoatomique idéal , il ne s’agit que de l’ énergie cinétique de translation du mouvement linéaire des atomes. Les particules monoatomiques ne tournent pas et ne vibrent pas. Le comportement du système est bien décrit par la théorie cinétique des gaz. La théorie cinétique repose sur le fait que lors d’une collision élastique entre une molécule à haute énergie cinétique et une autre à faible énergie cinétique, une partie de l’énergie sera transférée à la molécule à plus faible énergie cinétique. Cependant, pour les gaz polyatomiques, il existe une rotation etl’énergie cinétique vibratoire aussi.
où l’énergie cinétique microscopique, U kin , implique les mouvements de toutes les particules du système par rapport au repère du centre de masse. Pour un gaz monoatomique idéal , il ne s’agit que de l’ énergie cinétique de translation du mouvement linéaire des atomes. Les particules monoatomiques ne tournent pas et ne vibrent pas. Le comportement du système est bien décrit par la théorie cinétique des gaz. La théorie cinétique repose sur le fait que lors d’une collision élastique entre une molécule à haute énergie cinétique et une autre à faible énergie cinétique, une partie de l’énergie sera transférée à la molécule à plus faible énergie cinétique. Cependant, pour les gaz polyatomiques, il existe une rotation etl’énergie cinétique vibratoire aussi.
L’énergie potentielle microscopique, U pot , implique les liaisons chimiques entre les atomes qui constituent les molécules, les forces de liaison dans le noyau ainsi que les champs de forces physiques du système (par exemple, les champs électriques ou magnétiques).
Dans les liquides et les solides, il existe une composante importante d’énergie potentielle associée aux forces attractives intermoléculaires .
Énergie thermique et chaleur
 Alors que l’ énergie thermique fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet, la chaleur est la quantité d’énergie circulant d’un corps à un autre spontanément en raison de leur différence de température. La chaleur est une forme d’énergie, mais c’est de l’ énergie en transit . La chaleur n’est pas la propriété d’un système. Cependant, le transfert d’énergie sous forme de chaleur se produit au niveau moléculaire en raison d’une différence de température .
Alors que l’ énergie thermique fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet, la chaleur est la quantité d’énergie circulant d’un corps à un autre spontanément en raison de leur différence de température. La chaleur est une forme d’énergie, mais c’est de l’ énergie en transit . La chaleur n’est pas la propriété d’un système. Cependant, le transfert d’énergie sous forme de chaleur se produit au niveau moléculaire en raison d’une différence de température .
Considérons un bloc de métal à haute température, composé d’atomes qui oscillent intensément autour de leur position moyenne. Aux basses températures , les atomes continuent d’osciller, mais avec moins d’intensité . Si un bloc de métal plus chaud est mis en contact avec un bloc plus froid, les atomes oscillant intensément au bord du bloc plus chaud dégagent son énergie cinétique aux atomes moins oscillants au bord du bloc froid. Dans ce cas, il y a un transfert d’énergie entre ces deux blocs et des flux de chaleur du bloc le plus chaud vers le bloc le plus froid par ces vibrations aléatoires.
Distinguer la température, la chaleur et l’énergie thermique
En utilisant la théorie cinétique, une distinction claire entre ces trois propriétés peut être faite.
- La température est liée aux énergies cinétiques des molécules d’un matériau. C’est l’énergie cinétique moyenne des molécules individuelles.
- L’énergie interne fait référence à l’énergie totale de toutes les molécules à l’intérieur de l’objet. C’est une propriété étendue , donc lorsque deux lingots chauds à masse égale d’acier peuvent avoir la même température, mais deux d’entre eux ont deux fois plus d’énergie interne que l’un.
- Enfin, la chaleur est la quantité d’énergie qui circule d’un corps à l’autre spontanément en raison de leur différence de température.
Il faut l’ajouter, lorsqu’il existe une différence de température , la chaleur s’écoule spontanément du système le plus chaud vers le système le plus froid . Ainsi, si un cube d’acier de 5 kg à 100 ° C est mis en contact avec un cube d’acier de 500 kg à 20 ° C, la chaleur circule du cube à 300 ° C vers le cube à 20 ° C même si l’énergie interne du cube à 20 ° C est beaucoup plus grand car il y en a tellement plus.
Un concept particulièrement important est l’équilibre thermodynamique . En général, lorsque deux objets sont mis en contact thermique , la chaleur circule entre eux jusqu’à ce qu’ils s’équilibrent .
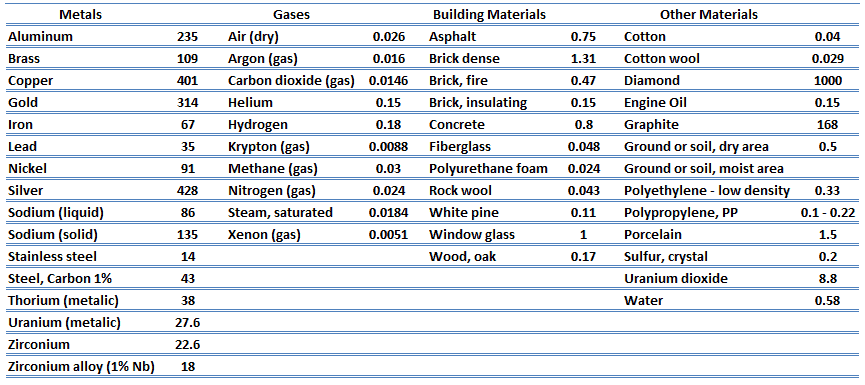
Conductivité thermique
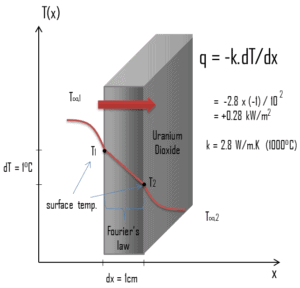 Les caractéristiques de transfert de chaleur d’un matériau solide sont mesurées par une propriété appelée conductivité thermique , k (ou λ), mesurée en W / mK . Il s’agit d’une mesure de la capacité d’une substance à transférer de la chaleur à travers un matériau par conduction. Notez que la loi de Fourier s’applique à toute matière, quel que soit son état (solide, liquide ou gaz), elle est donc également définie pour les liquides et les gaz.
Les caractéristiques de transfert de chaleur d’un matériau solide sont mesurées par une propriété appelée conductivité thermique , k (ou λ), mesurée en W / mK . Il s’agit d’une mesure de la capacité d’une substance à transférer de la chaleur à travers un matériau par conduction. Notez que la loi de Fourier s’applique à toute matière, quel que soit son état (solide, liquide ou gaz), elle est donc également définie pour les liquides et les gaz.
La conductivité thermique de la plupart des liquides et solides varie avec la température. Pour les vapeurs, cela dépend aussi de la pression. En général:
La plupart des matériaux sont très homogènes, nous pouvons donc généralement écrire k = k (T) . Des définitions similaires sont associées aux conductivités thermiques dans les directions y et z (k y , k z ), mais pour un matériau isotrope, la conductivité thermique est indépendante de la direction de transfert, k x = k y = k z = k.
De l’équation précédente, il s’ensuit que le flux de chaleur de conduction augmente avec l’augmentation de la conductivité thermique et augmente avec l’augmentation de la différence de température. En général, la conductivité thermique d’un solide est supérieure à celle d’un liquide, qui est supérieure à celle d’un gaz. Cette tendance est due en grande partie aux différences d’ espacement intermoléculaire pour les deux états de la matière. En particulier, le diamant a la dureté et la conductivité thermique les plus élevées de tous les matériaux en vrac.
Énergie interne et première loi de la thermodynamique
En thermodynamique, le concept d’énergie est élargi pour tenir compte des autres changements observés, et le principe de conservation de l’énergie est étendu pour inclure une grande variété de façons dont les systèmes interagissent avec leur environnement. Les seules façons dont l’énergie d’un système fermé peut être modifiée sont le transfert d’énergie par le travail ou par la chaleur . De plus, sur la base des expériences de Joule et d’autres, un aspect fondamental du concept énergétique est que l’ énergie est conservée. Ce principe est connu comme le première principe de la thermodynamique . La première loi de la thermodynamique peut s’écrire sous différentes formes:
Dans les mots:
Formulaire d’équation:
∆E int = Q – W
où E int représente l’ énergie interne du matériau, qui ne dépend que de l’ état du matériau (température, pression et volume). Q est la chaleur nette ajoutée au système et W est le travail net effectué par le système. Nous devons être prudents et cohérents en suivant les conventions de signe pour Q et W. Parce que W dans l’équation est le travail effectué par le système, alors si le travail est effectué sur le système, W sera négatif et E int augmentera.
De même, Q est positif pour la chaleur ajoutée au système, donc si la chaleur quitte le système, Q est négative. Cela nous dit ce qui suit: L’ énergie interne d’un système a tendance à augmenter si la chaleur est absorbée par le système ou si un travail positif est effectué sur le système. Inversement, l’énergie interne a tendance à diminuer si la chaleur est perdue par le système ou si un travail négatif est effectué sur le système. Il faut ajouter que Q et W dépendent du chemin, tandis que E int est indépendant du chemin.
Forme différentielle:
dE int = dQ – dW
L’énergie interne E int d’un système a tendance à augmenter si de l’énergie est ajoutée sous forme de chaleur Q et a tendance à diminuer si de l’énergie est perdue en tant que travail W effectué par le système.
Voir aussi: Système ouvert – Système fermé – Système isolé
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci