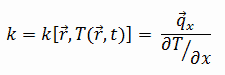Wärmeenergie – Definition
Wärmeenergie – Definition
In der Thermodynamik wird Wärmeenergie (auch als innere Energie bezeichnet ) als die Energie definiert, die mit mikroskopischen Energieformen verbunden ist . Es handelt sich um eine umfangreiche Menge , die von der Größe des Systems oder der Menge der darin enthaltenen Substanz abhängt. Die SI-Einheit der Wärmeenergie ist das Joule (J) . Es ist die im System enthaltene Energie, ohne die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Systems. Mikroskopische Energieformen sind solche, die auf Rotation , Vibration, Translation und Wechselwirkungen zurückzuführen sind unter den Molekülen einer Substanz. Keine dieser Energieformen kann direkt gemessen oder ausgewertet werden, es wurden jedoch Techniken entwickelt, um die Veränderung der Gesamtsumme all dieser mikroskopischen Energieformen zu bewerten.
Mikroskopische Energie
Wärmeenergie – Definition
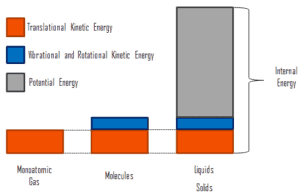
Interne Energie beinhaltet Energie im mikroskopischen Maßstab . Es kann in mikroskopische potentielle Energie, U Pot , und mikroskopische kinetische Energie, U Kin , unterteilt werden:
U = U Pot + U Kin
 wobei die mikroskopische kinetische Energie U kin die Bewegungen aller Systemteilchen in Bezug auf den Schwerpunktrahmen umfasst. Für ein ideales einatomiges Gas ist dies nur die translatorische kinetische Energie der linearen Bewegung der Atome. Einatomige Partikel drehen oder vibrieren nicht. Das Verhalten des Systems wird durch die kinetische Theorie der Gase gut beschrieben. Die kinetische Theorie basiert auf der Tatsache, dass bei einer elastischen Kollision zwischen einem Molekül mit hoher kinetischer Energie und einem Molekül mit niedriger kinetischer Energie ein Teil der Energie auf das Molekül mit niedrigerer kinetischer Energie übertragen wird. Für mehratomige Gase gibt es jedoch Rotations- undauch die kinetische Schwingungsenergie .
wobei die mikroskopische kinetische Energie U kin die Bewegungen aller Systemteilchen in Bezug auf den Schwerpunktrahmen umfasst. Für ein ideales einatomiges Gas ist dies nur die translatorische kinetische Energie der linearen Bewegung der Atome. Einatomige Partikel drehen oder vibrieren nicht. Das Verhalten des Systems wird durch die kinetische Theorie der Gase gut beschrieben. Die kinetische Theorie basiert auf der Tatsache, dass bei einer elastischen Kollision zwischen einem Molekül mit hoher kinetischer Energie und einem Molekül mit niedriger kinetischer Energie ein Teil der Energie auf das Molekül mit niedrigerer kinetischer Energie übertragen wird. Für mehratomige Gase gibt es jedoch Rotations- undauch die kinetische Schwingungsenergie .
Die mikroskopische potentielle Energie U pot beinhaltet die chemischen Bindungen zwischen den Atomen, aus denen die Moleküle bestehen, die Bindungskräfte im Kern sowie die physikalischen Kraftfelder innerhalb des Systems (z. B. elektrische oder magnetische Felder).
In Flüssigkeiten und Feststoffen ist ein erheblicher Anteil der potentiellen Energie mit den intermolekularen Anziehungskräften verbunden .
Wärmeenergie und Wärme
 Während sich Wärmeenergie auf die Gesamtenergie aller Moleküle im Objekt bezieht, ist Wärme die Energiemenge, die aufgrund ihrer Temperaturdifferenz spontan von einem Körper zum anderen fließt . Wärme ist eine Energieform, aber es ist Energie auf dem Transportweg . Wärme ist keine Eigenschaft eines Systems. Die Energieübertragung als Wärme erfolgt jedoch auf molekularer Ebene infolge eines Temperaturunterschieds .
Während sich Wärmeenergie auf die Gesamtenergie aller Moleküle im Objekt bezieht, ist Wärme die Energiemenge, die aufgrund ihrer Temperaturdifferenz spontan von einem Körper zum anderen fließt . Wärme ist eine Energieform, aber es ist Energie auf dem Transportweg . Wärme ist keine Eigenschaft eines Systems. Die Energieübertragung als Wärme erfolgt jedoch auf molekularer Ebene infolge eines Temperaturunterschieds .
Stellen Sie sich einen Metallblock mit hoher Temperatur vor, der aus Atomen besteht, die stark um ihre Durchschnittspositionen schwingen. Bei niedrigen Temperaturen schwingen die Atome weiter, jedoch mit geringerer Intensität . Wenn ein heißerer Metallblock mit einem kühleren Block in Kontakt gebracht wird, geben die stark oszillierenden Atome am Rand des heißeren Blocks ihre kinetische Energie an die weniger oszillierenden Atome am Rand des kühlen Blocks ab. In diesem Fall findet eine Energieübertragung zwischen diesen beiden Blöcken statt und durch diese zufälligen Vibrationen fließt Wärme vom heißeren zum kühleren Block.
Unterscheidung von Temperatur, Wärme und Wärmeenergie
Mit der kinetischen Theorie kann klar zwischen diesen drei Eigenschaften unterschieden werden.
- Die Temperatur hängt mit den kinetischen Energien der Moleküle eines Materials zusammen. Es ist die durchschnittliche kinetische Energie einzelner Moleküle.
- Interne Energie bezieht sich auf die Gesamtenergie aller Moleküle im Objekt. Es ist eine weitreichende Eigenschaft , wenn zwei gleich große heiße Barren aus Stahl die gleiche Temperatur haben können, aber zwei von ihnen doppelt so viel innere Energie haben wie einer.
- Schließlich ist Wärme die Energiemenge, die aufgrund ihres Temperaturunterschieds spontan von einem Körper zum anderen fließt.
Es muss hinzugefügt werden, wenn ein Temperaturunterschied besteht. Die Wärme fließt spontan vom wärmeren System zum kälteren System . Wenn also ein 5 kg schwerer Stahlwürfel bei 100 ° C mit einem 500 kg schweren Stahlwürfel bei 20 ° C in Kontakt gebracht wird, fließt Wärme vom Würfel bei 300 ° C zum Würfel bei 20 ° C, obwohl die innere Energie vorhanden ist des 20 ° C Würfels ist viel größer, weil es so viel mehr davon gibt.
Ein besonders wichtiges Konzept ist das thermodynamische Gleichgewicht . Wenn zwei Objekte in thermischen Kontakt gebracht werden , fließt im Allgemeinen Wärme zwischen ihnen, bis sie sich im Gleichgewicht befinden .
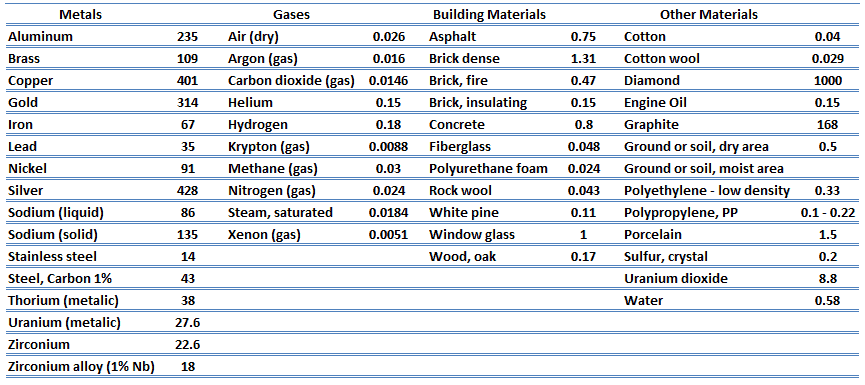
Wärmeleitfähigkeit
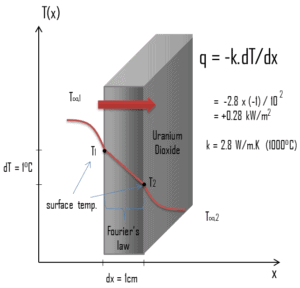 Die Wärmeübertragungseigenschaften eines festen Materials werden durch eine Eigenschaft gemessen, die als Wärmeleitfähigkeit k (oder λ) bezeichnet wird und in W / mK gemessen wird . Es ist ein Maß für die Fähigkeit eines Stoffes, Wärme durch Wärmeleitung durch ein Material zu übertragen. Beachten Sie, dass das Fourier-Gesetz für alle Materie gilt, unabhängig von ihrem Zustand (fest, flüssig oder gasförmig). Daher gilt es auch für Flüssigkeiten und Gase.
Die Wärmeübertragungseigenschaften eines festen Materials werden durch eine Eigenschaft gemessen, die als Wärmeleitfähigkeit k (oder λ) bezeichnet wird und in W / mK gemessen wird . Es ist ein Maß für die Fähigkeit eines Stoffes, Wärme durch Wärmeleitung durch ein Material zu übertragen. Beachten Sie, dass das Fourier-Gesetz für alle Materie gilt, unabhängig von ihrem Zustand (fest, flüssig oder gasförmig). Daher gilt es auch für Flüssigkeiten und Gase.
Die Wärmeleitfähigkeit der meisten Flüssigkeiten und Feststoffe variiert mit der Temperatur. Bei Dämpfen kommt es auch auf den Druck an. Allgemein:
Die meisten Materialien sind nahezu homogen, daher können wir normalerweise k = k (T) schreiben . Ähnliche Definitionen sind mit Wärmeleitfähigkeiten in y- und z-Richtung (k y , k z ) verbunden, aber für ein isotropes Material ist die Wärmeleitfähigkeit unabhängig von der Übertragungsrichtung, k x = k y = k z = k.
Aus der vorstehenden Gleichung folgt, dass der Wärmeleitungsfluss mit zunehmender Wärmeleitfähigkeit zunimmt und mit zunehmender Temperaturdifferenz zunimmt. Im Allgemeinen ist die Wärmeleitfähigkeit eines Feststoffs größer als die einer Flüssigkeit, die größer als die eines Gases ist. Dieser Trend ist hauptsächlich auf Unterschiede im intermolekularen Abstand für die beiden Materiezustände zurückzuführen. Insbesondere hat Diamant die höchste Härte und Wärmeleitfähigkeit aller Schüttgüter.
Innere Energie und der erste Hauptsatz der Thermodynamik
In der Thermodynamik wird das Energiekonzept erweitert, um andere beobachtete Änderungen zu berücksichtigen, und das Prinzip der Energieerhaltung wird um eine Vielzahl von Arten der Interaktion von Systemen mit ihrer Umgebung erweitert. Die Energie eines geschlossenen Systems kann nur durch Energieübertragung durch Arbeit oder Wärme verändert werden . Basierend auf den Experimenten von Joule und anderen ist ein grundlegender Aspekt des Energiekonzepts, dass Energie erhalten bleibt. Dieses Prinzip ist als erster Hauptsatz der Thermodynamik bekannt . Der erste Hauptsatz der Thermodynamik kann in verschiedenen Formen geschrieben werden:
In Worten:
Gleichungsform:
∆E int = Q – W.
Dabei steht E int für die innere Energie des Materials, die nur vom Zustand des Materials (Temperatur, Druck und Volumen) abhängt . Q ist die Netto-Wärmezufuhr an das System und W ist das Netz durch geleistete Arbeit das System. Wir müssen vorsichtig und konsequent sein, wenn wir die Vorzeichenkonventionen für Q und W befolgen. Da W in der Gleichung die vom System geleistete Arbeit ist, ist W negativ und E int nimmt zu , wenn am System gearbeitet wird.
In ähnlicher Weise ist Q positiv für die dem System zugeführte Wärme. Wenn also Wärme das System verlässt, ist Q negativ. Dies sagt uns Folgendes: Die interne Energie eines Systems steigt tendenziell an, wenn Wärme vom System absorbiert wird oder wenn positive Arbeit am System geleistet wird. Umgekehrt neigt die interne Energie dazu, abzunehmen, wenn das System Wärme verliert oder wenn negative Arbeiten am System ausgeführt werden. Es muss hinzugefügt werden, dass Q und W pfadabhängig sind, während E int pfadunabhängig ist.
Differentialform:
dE int = dQ – dW
Die interne Energie E int eines Systems nimmt tendenziell zu, wenn Energie als Wärme Q hinzugefügt wird, und nimmt tendenziell ab, wenn Energie als vom System geleistete Arbeit W verloren geht.
Siehe auch: Offenes System – Geschlossenes System – Isoliertes System
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.