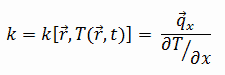Energía térmica – Definición
Energía térmica – Definición
En termodinámica, la energía térmica (también llamada energía interna ) se define como la energía asociada con formas microscópicas de energía . Es una cantidad extensa , depende del tamaño del sistema o de la cantidad de sustancia que contiene. La unidad SI de energía térmica es el julio (J) . Es la energía contenida dentro del sistema, excluyendo la energía cinética de movimiento del sistema como un todo y la energía potencial del sistema. Las formas microscópicas de energía incluyen aquellas debidas a la rotación , vibración, traslación e interacciones. entre las moléculas de una sustancia. Ninguna de estas formas de energía se puede medir o evaluar directamente, pero se han desarrollado técnicas para evaluar el cambio en la suma total de todas estas formas microscópicas de energía.
Energía microscópica
Energía térmica – Definición
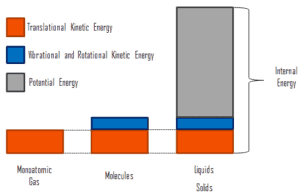
La energía interna implica energía a escala microscópica . Se puede dividir en energía potencial microscópica, U pot , y energía cinética microscópica, U kin , componentes:
U = U pot + U kin
 donde la energía cinética microscópica, U kin , involucra los movimientos de todas las partículas del sistema con respecto al marco del centro de masa. Para un gas monoatómico ideal , esto es solo la energía cinética traslacional del movimiento lineal de los átomos. Las partículas monoatómicas no giran ni vibran. El comportamiento del sistema está bien descrito por la teoría cinética de los gases. La teoría cinética se basa en el hecho de que durante una colisión elástica entre una molécula con alta energía cinética y otra con baja energía cinética, parte de la energía se transferirá a la molécula de menor energía cinética. Sin embargo, para los gases poliatómicos hay rotación yenergía cinética vibracional también.
donde la energía cinética microscópica, U kin , involucra los movimientos de todas las partículas del sistema con respecto al marco del centro de masa. Para un gas monoatómico ideal , esto es solo la energía cinética traslacional del movimiento lineal de los átomos. Las partículas monoatómicas no giran ni vibran. El comportamiento del sistema está bien descrito por la teoría cinética de los gases. La teoría cinética se basa en el hecho de que durante una colisión elástica entre una molécula con alta energía cinética y otra con baja energía cinética, parte de la energía se transferirá a la molécula de menor energía cinética. Sin embargo, para los gases poliatómicos hay rotación yenergía cinética vibracional también.
La energía potencial microscópica, U pot , involucra los enlaces químicos entre los átomos que forman las moléculas, las fuerzas de unión en el núcleo y también los campos de fuerza física dentro del sistema (por ejemplo, campos eléctricos o magnéticos).
En líquidos y sólidos hay un componente significativo de energía potencial asociado con las fuerzas de atracción intermoleculares .
Energía Térmica y Calor
 Mientras que la energía térmica se refiere a la energía total de todas las moléculas dentro del objeto, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura. El calor es una forma de energía, pero es energía en tránsito . El calor no es una propiedad de un sistema. Sin embargo, la transferencia de energía como calor ocurre a nivel molecular como resultado de una diferencia de temperatura .
Mientras que la energía térmica se refiere a la energía total de todas las moléculas dentro del objeto, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura. El calor es una forma de energía, pero es energía en tránsito . El calor no es una propiedad de un sistema. Sin embargo, la transferencia de energía como calor ocurre a nivel molecular como resultado de una diferencia de temperatura .
Considere un bloque de metal a alta temperatura, que consiste en átomos que oscilan intensamente alrededor de sus posiciones promedio. A bajas temperaturas , los átomos continúan oscilando, pero con menos intensidad . Si un bloque de metal más caliente se pone en contacto con un bloque más frío, los átomos que oscilan intensamente en el borde del bloque más caliente emiten su energía cinética a los átomos menos oscilantes en el borde del bloque frío. En este caso, hay una transferencia de energía entre estos dos bloques y el calor fluye desde el bloque más caliente al más frío por estas vibraciones aleatorias.
Distinguir temperatura, calor y energía térmica
Usando la teoría cinética, se puede hacer una distinción clara entre estas tres propiedades.
- La temperatura está relacionada con las energías cinéticas de las moléculas de un material. Es la energía cinética promedio de las moléculas individuales.
- La energía interna se refiere a la energía total de todas las moléculas dentro del objeto. Es una propiedad extensa , por lo tanto, cuando dos lingotes de acero de masa igual pueden tener la misma temperatura, pero dos de ellos tienen el doble de energía interna que uno.
- Finalmente, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura.
Debe agregarse, cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío . Por lo tanto, si un cubo de acero de 5 kg a 100 ° C se pone en contacto con un cubo de acero de 500 kg a 20 ° C, el calor fluye desde el cubo a 300 ° C al cubo a 20 ° C, aunque la energía interna del cubo de 20 ° C es mucho mayor porque hay mucho más.
Un concepto particularmente importante es el equilibrio termodinámico . En general, cuando dos objetos se ponen en contacto térmico , el calor fluirá entre ellos hasta que se equilibren entre sí.
Conductividad térmica
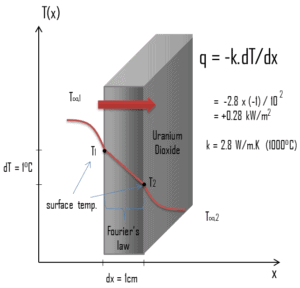 Las características de transferencia de calor de un material sólido se miden mediante una propiedad llamada conductividad térmica , k (o λ), medida en W / mK . Es una medida de la capacidad de una sustancia para transferir calor a través de un material por conducción. Tenga en cuenta que la ley de Fourier se aplica a toda la materia, independientemente de su estado (sólido, líquido o gaseoso), por lo tanto, también se define para líquidos y gases.
Las características de transferencia de calor de un material sólido se miden mediante una propiedad llamada conductividad térmica , k (o λ), medida en W / mK . Es una medida de la capacidad de una sustancia para transferir calor a través de un material por conducción. Tenga en cuenta que la ley de Fourier se aplica a toda la materia, independientemente de su estado (sólido, líquido o gaseoso), por lo tanto, también se define para líquidos y gases.
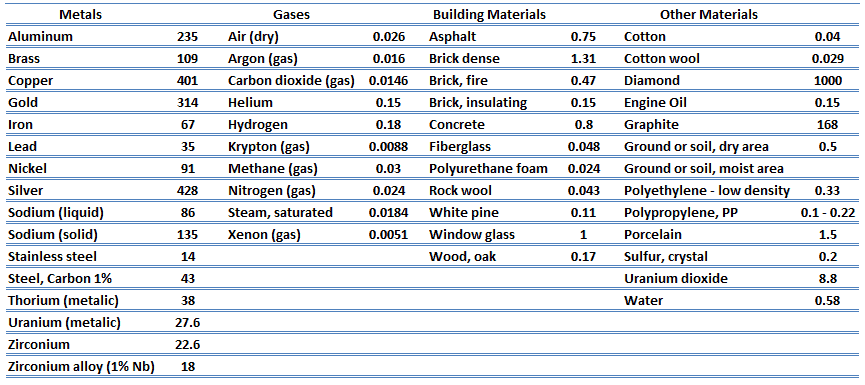
La conductividad térmica de la mayoría de los líquidos y sólidos varía con la temperatura. Para los vapores, también depende de la presión. En general:
La mayoría de los materiales son casi casi homogéneos, por lo tanto, generalmente podemos escribir k = k (T) . Definiciones similares se asocian con conductividades térmicas en las direcciones y y z (k y , k z ), pero para un material isotrópico la conductividad térmica es independiente de la dirección de transferencia, k x = k y = k z = k.
De la ecuación anterior, se deduce que el flujo de calor de conducción aumenta al aumentar la conductividad térmica y aumenta al aumentar la diferencia de temperatura. En general, la conductividad térmica de un sólido es mayor que la de un líquido, que es mayor que la de un gas. Esta tendencia se debe en gran parte a las diferencias en el espacio intermolecular para los dos estados de la materia. En particular, el diamante tiene la mayor dureza y conductividad térmica de cualquier material a granel.
Energía interna y la primera ley de la termodinámica.
En termodinámica, el concepto de energía se amplía para tener en cuenta otros cambios observados, y el principio de conservación de la energía se extiende para incluir una amplia variedad de formas en que los sistemas interactúan con su entorno. Las únicas formas en que se puede cambiar la energía de un sistema cerrado son mediante la transferencia de energía por trabajo o por calor . Además, según los experimentos de Joule y otros, un aspecto fundamental del concepto de energía es que la energía se conserva. Este principio se conoce como la primera ley de la termodinámica . La primera ley de la termodinámica se puede escribir en varias formas:
En palabras:
Forma de ecuación:
IntE int = Q – W
donde E int representa la energía interna del material, que depende solo del estado del material (temperatura, presión y volumen). Q es el calor neto agregado al sistema y W es el trabajo neto realizado por el sistema. Debemos ser cuidadosos y consistentes al seguir las convenciones de signos para Q y W. Como W en la ecuación es el trabajo realizado por el sistema, entonces si el trabajo se realiza en el sistema, W será negativo y E int aumentará.
Del mismo modo, Q es positivo para el calor agregado al sistema, por lo que si el calor abandona el sistema, Q es negativo. Esto nos dice lo siguiente: la energía interna de un sistema tiende a aumentar si el sistema absorbe calor o si se realiza un trabajo positivo en el sistema. Por el contrario, la energía interna tiende a disminuir si el sistema pierde calor o si se realiza un trabajo negativo en el sistema. Debe agregarse que Q y W dependen de la ruta, mientras que E int es independiente de la ruta.
Forma diferencial:
dE int = dQ – dW
La energía interna E int de un sistema tiende a aumentar si se agrega energía como calor Q y tiende a disminuir si se pierde energía como trabajo W realizado por el sistema.
Vea también: Sistema abierto – Sistema cerrado – Sistema aislado
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.