Entalpia em reações químicas
A entalpia é amplamente utilizada também na química. As reações químicas são determinadas pelas leis da termodinâmica . Na termodinâmica, a energia interna de um sistema é a energia contida no sistema, excluindo a energia cinética do movimento do sistema como um todo e a energia potencial do sistema como um todo devido a campos de força externos. A entalpia de uma reação química é definida como a alteração de entalpia observada em um constituinte de um sistema termodinâmico quando uma toupeira de substância reage completamente.
Como a maioria das reações químicas em laboratório são processos de pressão constante, podemos escrever a alteração na entalpia (também conhecida como entalpia de reação) para uma reação. A entalpia da reação pode ser positiva ou negativa ou zero, dependendo se o calor é ganho ou perdido ou se nenhum calor é perdido ou ganho. Em uma reação endotérmica , os produtos possuem mais energia química armazenada do que os reagentes. Numa reação exotérmica , o oposto é verdadeiro. Os produtos possuem menos energia química armazenada que os reagentes. O excesso de energia é geralmente liberado para o ambiente quando a reação ocorre.
Nas reações químicas , a energia é armazenada nas ligações químicas entre os átomos que compõem as moléculas. O armazenamento de energia no nível atômico inclui energia associada aos estados orbitais dos elétrons. Se uma reação química absorve ou libera energia, não há mudança geral na quantidade de energia durante a reação. Isso é devido à lei de conservação de energia , que afirma que:
A energia não pode ser criada ou destruída . A energia pode mudar de forma durante uma reação química .
Combustão de hidrogênio
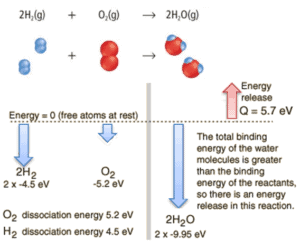
Considere a combustão de hidrogênio no ar. Em uma chama de gás hidrogênio puro, queimando no ar, o hidrogênio (H 2 ) reage com o oxigênio (O 2 ) para formar água (H 2 O) e libera energia .
Energicamente, o processo pode ser considerado para exigir a energia para dissociar o H 2 e O 2 , mas, em seguida, a ligação do inibidor da H 2 O retorna o sistema para um estado ligado com potencial negativo . Na verdade, é mais negativo do que os estados ligados dos reagentes, e a formação das duas moléculas de água é, portanto, uma reação exotérmica , que libera 5,7 eV de energia. Em palavras de entalpia, a entalpia de combustão é −286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
Em palavras de entalpia, a entalpia de combustão é -286 kJ / mol (energia por mol de hidrogênio molecular):
2H 2 (g) + O 2 (g) → 2H 2 O (l) +572 kJ
O balanço de energia antes e depois da reação pode ser ilustrado esquematicamente com o estado em que todos os átomos são livres, tomados como referência de energia.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.