Enthalpie dans les réactions chimiques
L’enthalpie est largement utilisée aussi en chimie. Les réactions chimiques sont déterminées par les lois de la thermodynamique . En thermodynamique, l’ énergie interne d’un système est l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système dans son ensemble en raison des champs de forces externes. L’enthalpie d’une réaction chimique est définie comme le changement d’enthalpie observé dans un constituant d’un système thermodynamique lorsqu’une mole de substance réagit complètement.
Comme la plupart des réactions chimiques en laboratoire sont des processus à pression constante, nous pouvons écrire le changement d’enthalpie (également connu sous le nom d’enthalpie de réaction) pour une réaction. L’enthalpie de réaction peut être positive ou négative ou égale à zéro, que la chaleur soit gagnée ou perdue ou pas ou non. Dans une réaction endothermique , les produits ont plus d’énergie chimique stockée que les réactifs. Dans une réaction exothermique , le contraire est vrai. Les produits ont moins d’énergie chimique stockée que les réactifs. L’énergie excédentaire est généralement libérée dans l’environnement lorsque la réaction se produit.
Dans les réactions chimiques , l’énergie est stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Le stockage d’énergie au niveau atomique inclut l’énergie associée aux états orbitaux des électrons. Qu’une réaction chimique absorbe ou libère de l’énergie, il n’y a pas de changement global de la quantité d’énergie au cours de la réaction. C’est à cause de la loi de la conservation de l’énergie , qui stipule que:
L’énergie ne peut être ni créée ni détruite . L’énergie peut changer de forme lors d’une réaction chimique .
Combustion de l’hydrogène
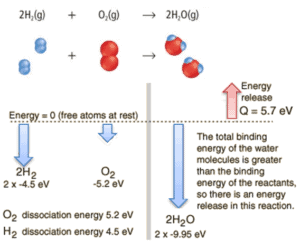
Considérons la combustion d’hydrogène dans l’air. Dans une flamme d’hydrogène gazeux pur, brûlant dans l’air, l’ hydrogène (H 2 ) réagit avec l’ oxygène (O 2 ) pour former de l’ eau (H 2 O) et libère de l’énergie .
Énergie, le procédé peut être considérée comme nécessitant de l’énergie pour dissocier le H 2 et O 2 , puis la liaison du H 2 O ramène le système à un état lié à un potentiel négatif . En réalité, il est plus négatif que les états liés des réactifs et la formation des deux molécules d’eau est donc une réaction exothermique , qui libère 5,7 eV d’énergie. En termes d’enthalpie, l’enthalpie de combustion est de −286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
En termes d’enthalpie, l’enthalpie de combustion est de −286 kJ / mol (énergie par mole d’hydrogène moléculaire):
2H 2 (g) + O 2 (g) → 2H 2 O (l) +572 kJ
L’équilibre énergétique avant et après la réaction peut être illustré schématiquement par l’état dans lequel tous les atomes sont libres pris comme référence pour l’énergie.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci