Entalpia em unidades intensivas – Entalpia específica
A entalpia pode ser transformada em uma variável intensiva ou específica dividindo-se pela massa . Os engenheiros usam mais a entalpia específica na análise termodinâmica do que a própria entalpia. A entalpia específica (h) de uma substância é a sua entalpia por unidade de massa. É igual à entalpia total (H) dividida pela massa total (m).
h = H / m
Onde:
h = entalpia específica (J / kg)
H = entalpia (J)
m = massa (kg)
Observe que a entalpia é a quantidade termodinâmica equivalente ao conteúdo total de calor de um sistema. A entalpia específica é igual à energia interna específica do sistema mais o produto da pressão e volume específico .
h = u + pv
Em geral, a entalpia é uma propriedade de uma substância , como pressão, temperatura e volume, mas não pode ser medida diretamente. Normalmente, a entalpia de uma substância é dada com relação a algum valor de referência. Por exemplo, a entalpia específica da água ou vapor é dada usando a referência de que a entalpia específica da água é zero a 0,01 ° C e pressão atmosférica normal , onde h L = 0,00 kJ / kg . O fato de o valor absoluto da entalpia específica ser desconhecido não é um problema, no entanto, porque é a alteração na entalpia específica (∆h) e não o valor absoluto que é importante nos problemas práticos.
Veja também: Tabelas Steam
Entalpia de vaporização
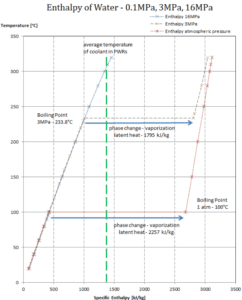
Em geral, quando um material muda de fase de sólido para líquido ou de líquido para gás, uma certa quantidade de energia está envolvida nessa mudança de fase. No caso de mudança de fase de líquido para gás, essa quantidade de energia é conhecida como entalpia de vaporização (símbolo ∆H vap ; unidade: J), também conhecida como calor (latente) de vaporização ou calor de evaporação. Calor latente é a quantidade de calor adicionada ou removida de uma substância para produzir uma mudança de fase. Essa energia decompõe as forças atraentes intermoleculares e também deve fornecer a energia necessária para expandir o gás (o trabalho pΔV) Quando o calor latente é adicionado, nenhuma mudança de temperatura ocorre. A entalpia da vaporização é uma função da pressão na qual essa transformação ocorre.
Calor latente de vaporização – água a 0,1 MPa (pressão atmosférica)
h lg = 2257 kJ / kg
Calor latente de vaporização – água a 3 MPa (pressão dentro de um gerador de vapor)
h lg = 1795 kJ / kg
Calor latente de vaporização – água a 16 MPa (pressão dentro de um pressurizador )
h lg = 931 kJ / kg
O calor da vaporização diminui com o aumento da pressão, enquanto o ponto de ebulição aumenta. Ele desaparece completamente em um determinado ponto chamado ponto crítico . Acima do ponto crítico, as fases líquida e de vapor são indistinguíveis, e a substância é chamada de fluido supercrítico .
O calor da vaporização é o calor necessário para vaporizar completamente uma unidade de líquido saturado (ou condensar uma unidade de massa de vapor saturado) e é igual a h lg = h g – h l .
O calor necessário para derreter (ou congelar) uma unidade de massa na substância a pressão constante é o calor da fusão e é igual a h sl = h l – h s , onde h s é a entalpia do sólido saturado e h l é a entalpia do líquido saturado.
Entalpia específica do vapor úmido
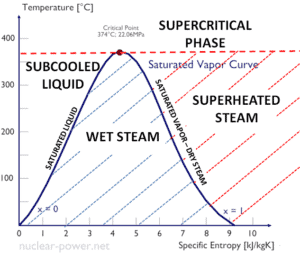 A entalpia específica da água líquida saturada (x = 0) e do vapor seco (x = 1) pode ser selecionada nas tabelas de vapor. No caso do vapor molhado , a entalpia real pode ser calculado com a qualidade de vapor, x , e as entalpias específicas de água no estado líquido saturado e vapor seco:
A entalpia específica da água líquida saturada (x = 0) e do vapor seco (x = 1) pode ser selecionada nas tabelas de vapor. No caso do vapor molhado , a entalpia real pode ser calculado com a qualidade de vapor, x , e as entalpias específicas de água no estado líquido saturado e vapor seco:
h molhado = h s x + (1 – x) h l
Onde
h úmido = entalpia do vapor úmido (J / kg)
h s = entalpia do vapor “seco” (J / kg)
h l = entalpia de água líquida saturada (J / kg)
Como pode ser visto, o vapor úmido sempre terá entalpia menor do que o vapor seco.
Exemplo:
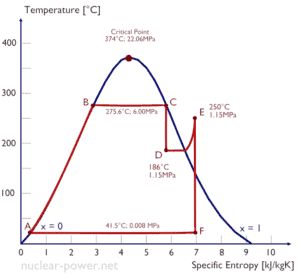
Um estágio de alta pressão da turbina a vapor opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto C). O vapor sai deste estágio da turbina a uma pressão de 1,15 MPa, 186 ° C ex = 0,87 (ponto D). Calcule a diferença de entalpia entre esses dois estados.
A entalpia para o estado C pode ser coletada diretamente das tabelas de vapor, enquanto a entalpia para o estado D deve ser calculada usando a qualidade do vapor:
h 1, molhado = 2785 kJ / kg
h 2, molhado = h 2, s x + (1 – x) h 2, l = 2782. 0,87 + (1 – 0,87). 790 = 2420 + 103 = 2523 kJ / kg
Δh = 262 kJ / kg
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.