Enthalpie bei chemischen Reaktionen
Die Enthalpie ist auch in der Chemie weit verbreitet . Chemische Reaktionen werden durch die Gesetze der Thermodynamik bestimmt . In der Thermodynamik ist die innere Energie eines Systems die im System enthaltene Energie, wobei die kinetische Bewegungsenergie des Gesamtsystems und die potentielle Energie des Gesamtsystems aufgrund externer Kraftfelder ausgeschlossen sind. Die Enthalpie einer chemischen Reaktion ist definiert als die Enthalpieänderung, die in einem Bestandteil eines thermodynamischen Systems beobachtet wird, wenn ein Mol Substanz vollständig reagiert.
Da es sich bei den meisten chemischen Reaktionen im Labor um Prozesse mit konstantem Druck handelt, können wir die Änderung der Enthalpie (auch als Reaktionsenthalpie bezeichnet) für eine Reaktion schreiben. Die Reaktionsenthalpie kann positiv oder negativ oder null sein, abhängig davon, ob die Wärme gewonnen oder verloren wird oder keine Wärme verloren oder gewonnen wird. Bei einer endothermen Reaktion haben die Produkte mehr gespeicherte chemische Energie als die Reaktanten. Bei einer exothermen Reaktion ist das Gegenteil der Fall. Die Produkte haben weniger gespeicherte chemische Energie als die Reaktanten. Die überschüssige Energie wird im Allgemeinen bei der Reaktion an die Umgebung abgegeben.
Bei chemischen Reaktionen wird Energie in den chemischen Bindungen zwischen den Atomen gespeichert , aus denen die Moleküle bestehen. Die Energiespeicherung auf atomarer Ebene umfasst Energie, die mit den Orbitalzuständen der Elektronen assoziiert ist. Unabhängig davon, ob eine chemische Reaktion Energie absorbiert oder abgibt, ändert sich die Energiemenge während der Reaktion insgesamt nicht. Das liegt am Energieerhaltungssatz , der besagt, dass:
Energie kann nicht erzeugt oder zerstört werden . Energie kann sich während einer chemischen Reaktion verändern .
Verbrennung von Wasserstoff
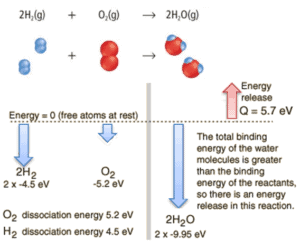
Betrachten Sie die Verbrennung von Wasserstoff in Luft. In einer in Luft brennenden Flamme aus reinem Wasserstoffgas reagiert der Wasserstoff (H 2 ) mit Sauerstoff (O 2 ) zu Wasser (H 2 O) und setzt Energie frei .
In energetischer Hinsicht kann davon ausgegangen werden, dass der Prozess die Energie benötigt, um H 2 und O 2 zu dissoziieren , aber dann bringt die Bindung des H 2 O das System in einen gebundenen Zustand mit negativem Potenzial zurück . Es ist tatsächlich negativer als die gebundenen Zustände der Reaktanten, und die Bildung der beiden Wassermoleküle ist daher eine exotherme Reaktion , die 5,7 eV Energie freisetzt. In Worten der Enthalpie beträgt die Enthalpie der Verbrennung –286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
In Worten der Enthalpie beträgt die Verbrennungsenthalpie –286 kJ / mol (Energie pro Mol molekularen Wasserstoffs):
2H 2 (g) + O 2 (g) → 2H 2 O ( 1 ) + 572 kJ
Das Gleichgewicht der Energie vor und nach der Reaktion kann schematisch mit dem Zustand dargestellt werden, in dem alle Atome frei sind, als Referenz für die Energie genommen.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.