Entalpía en reacciones químicas
La entalpía es ampliamente utilizada también en química. Las reacciones químicas están determinadas por las leyes de la termodinámica . En termodinámica, la energía interna de un sistema es la energía contenida dentro del sistema, excluyendo la energía cinética de movimiento del sistema en su conjunto y la energía potencial del sistema en su conjunto debido a los campos de fuerza externos. La entalpía de una reacción química se define como el cambio de entalpía observado en un componente de un sistema termodinámico cuando un mol de sustancia reacciona por completo.
Como la mayoría de las reacciones químicas en el laboratorio son procesos de presión constante, podemos escribir el cambio en la entalpía (también conocida como entalpía de reacción) para una reacción. La entalpía de reacción puede ser positiva o negativa o cero, dependiendo de si el calor se gana o se pierde o no se pierde o gana calor. En una reacción endotérmica , los productos tienen más energía química almacenada que los reactivos. En una reacción exotérmica , lo contrario es cierto. Los productos tienen menos energía química almacenada que los reactivos. El exceso de energía generalmente se libera a los alrededores cuando ocurre la reacción.
En las reacciones químicas , la energía se almacena en los enlaces químicos entre los átomos que forman las moléculas. El almacenamiento de energía a nivel atómico incluye energía asociada con estados orbitales de electrones. Ya sea que una reacción química absorba o libere energía, no hay un cambio general en la cantidad de energía durante la reacción. Eso se debe a la ley de conservación de la energía , que establece que:
La energía no puede ser creada o destruida . La energía puede cambiar de forma durante una reacción química .
Combustión de Hidrógeno
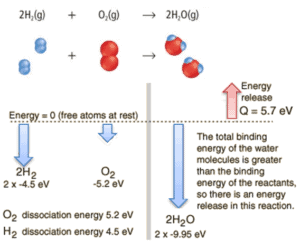
Considere la combustión de hidrógeno en el aire. En una llama de hidrógeno puro, que se quema en el aire, el hidrógeno (H 2 ) reacciona con el oxígeno (O 2 ) para formar agua (H 2 O) y libera energía .
Energéticamente, el proceso se puede considerar para requerir la energía para disociar el H 2 y O 2 , pero entonces la unión de la H 2 O devuelve el sistema a un estado ligado con potencial negativo . En realidad, es más negativo que los estados unidos de los reactivos, y la formación de las dos moléculas de agua es, por lo tanto, una reacción exotérmica , que libera 5,7 eV de energía. En palabras de entalpía, la entalpía de combustión es −286 kJ / mol:
2H 2 (g) + O 2 (g) → 2H 2 O (g)
En palabras de entalpía, la entalpía de combustión es -286 kJ / mol (energía por mol de hidrógeno molecular):
2H 2 (g) + O 2 (g) → 2H 2 O (l) +572 kJ
El equilibrio de energía antes y después de la reacción se puede ilustrar esquemáticamente con el estado en el que todos los átomos se toman libremente como referencia para la energía.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.