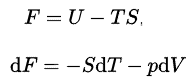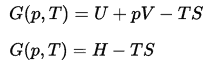Potenciais termodinâmicos
Potenciais termodinâmicos são quantidades escalares usadas para representar funções de estado. Juntamente com as equações correspondentes de estado, os potenciais termodinâmicos descrevem o comportamento de equilíbrio de um sistema em função das chamadas “variáveis naturais”.
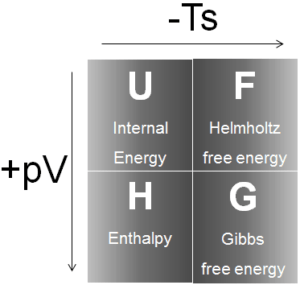
Quatro potenciais termodinâmicos comuns são:
Energia interna
Na termodinâmica, energia interna (também chamada de energia térmica ) é definida como a energia associada a formas microscópicas de energia . É uma quantidade extensa , depende do tamanho do sistema ou da quantidade de substância que ele contém. A unidade SI de energia interna é o joule (J) . É a energia contida no sistema, excluindo a energia cinética do movimento do sistema como um todo e a energia potencial do sistema. As formas microscópicas de energia incluem aquelas devidas à rotação , vibração, translação e interaçõesentre as moléculas de uma substância. Nenhuma dessas formas de energia pode ser medida ou avaliada diretamente, mas técnicas foram desenvolvidas para avaliar a mudança na soma total de todas essas formas microscópicas de energia.
Além disso, a energia é armazenada nas ligações químicas entre os átomos que compõem as moléculas. Esse armazenamento de energia no nível atômico inclui energia associada a estados orbitais de elétrons, rotação nuclear e forças de ligação no núcleo.
Entalpia
Na termodinâmica, a entalpia é uma medida de energia em um sistema termodinâmico. É a quantidade termodinâmica equivalente ao conteúdo total de calor de um sistema. A entalpia é definida como a soma da energia interna E mais o produto da pressão pe volume V. Em muitas análises termodinâmicas, a soma da energia interna U e o produto da pressão pe volume V aparece, portanto, é conveniente para dar à combinação um nome, entalpia e um símbolo distinto, H.
H = U + pV
A entalpia é a expressão preferida das mudanças de energia do sistema em muitas medições químicas, biológicas e físicas a pressão constante . É tão útil que é tabulado nas tabelas de vapor, juntamente com volume específico e energia interna específica . Isso se deve ao fato de simplificar a descrição da transferência de energia . Em pressão constante, a mudança de entalpia é igual à energia transferida do ambiente através do aquecimento (Q = H 2 – H 1 ) ou outro trabalho que não o trabalho de expansão. Para um processo de pressão variável, a diferença na entalpia não é tão óbvia.
Helmholtz Free Energy
Na termodinâmica, a energia livre de Helmholtz é um potencial termodinâmico que é definido como a energia interna do sistema menos o produto da temperatura vezes a entropia do sistema. mede o trabalho “útil” que pode ser obtido de um sistema termodinâmico fechado a um volume e pressão constantes. A energia livre Helmhotz é definida como:
A energia interna, U, tem um significado físico exato, é a soma de todas as energias cinética e potencial de todas as partículas no sistema. O segundo termo é a quantidade de transferência espontânea de energia, TS, onde S é a entropia final do sistema. Para um processo de temperatura constante, a energia livre de Helmholtz fornece todo o trabalho reversível. Quando um físico diz “energia livre” sem indicar Helmholtz ou Gibbs, eles geralmente significam energia livre de Helmholtz, por outro lado, quando um químico diz “energia livre”, quase sempre significa energia livre de Gibbs .
Gibbs Free Energy
Na termodinâmica, a energia livre de Gibbs é um potencial termodinâmico que é definido como a entalpia do sistema menos o produto da temperatura vezes a entropia do sistema. Como a entalpia é definida como a soma da energia interna E mais o produto da pressão pe volume V, a energia livre de Gibbs é definida como:
A mudança na energia livre de Gibbs, ΔG , na química, é um parâmetro muito útil. Pode ser pensado como a quantidade máxima de trabalho obtida a partir de uma reação.
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.