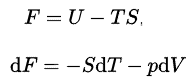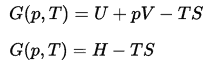Potenciales termodinámicos
Los potenciales termodinámicos son cantidades escalares utilizadas para representar funciones de estado. Junto con las ecuaciones de estado correspondientes, los potenciales termodinámicos describen el comportamiento de equilibrio de un sistema en función de las llamadas “variables naturales”.
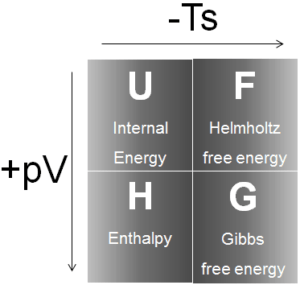
Cuatro potenciales termodinámicos comunes son:
Energía interna
En termodinámica, la energía interna (también llamada energía térmica ) se define como la energía asociada con formas microscópicas de energía . Es una cantidad extensa , depende del tamaño del sistema o de la cantidad de sustancia que contiene. La unidad SI de energía interna es el julio (J) . Es la energía contenida dentro del sistema, excluyendo la energía cinética de movimiento del sistema como un todo y la energía potencial del sistema. Las formas microscópicas de energía incluyen aquellas debidas a la rotación , vibración, traslación e interacciones.entre las moléculas de una sustancia. Ninguna de estas formas de energía se puede medir o evaluar directamente, pero se han desarrollado técnicas para evaluar el cambio en la suma total de todas estas formas microscópicas de energía.
Además, la energía se puede almacenar en los enlaces químicos entre los átomos que forman las moléculas. Este almacenamiento de energía a nivel atómico incluye energía asociada con estados orbitales de electrones, espín nuclear y fuerzas de unión en el núcleo.
Entalpía
En termodinámica, la entalpía es una medida de energía en un sistema termodinámico. Es la cantidad termodinámica equivalente al contenido de calor total de un sistema. La entalpía se define como la suma de la energía interna E más el producto de la presión py el volumen V. En muchos análisis termodinámicos aparece la suma de la energía interna U y el producto de la presión py el volumen V, por lo tanto, es conveniente para dar a la combinación un nombre, entalpía y un símbolo distintivo, H.
H = U + pV
La entalpía es la expresión preferida de los cambios de energía del sistema en muchas mediciones químicas, biológicas y físicas a presión constante . Es tan útil que está tabulado en las tablas de vapor junto con un volumen específico y una energía interna específica . Es debido al hecho, simplifica la descripción de la transferencia de energía . A presión constante, el cambio de entalpía es igual a la energía transferida desde el medio ambiente a través del calentamiento (Q = H 2 – H 1 ) u otro trabajo que no sea el trabajo de expansión. Para un proceso de presión variable, la diferencia en entalpía no es tan obvia.
Helmholtz Free Energy
En termodinámica, la energía libre de Helmholtz es un potencial termodinámico que se define como la energía interna del sistema menos el producto de la temperatura multiplicada por la entropía del sistema. mide el trabajo “útil” que se puede obtener de un sistema termodinámico cerrado a un volumen y presión constantes. La energía libre de Helmhotz se define como:
La energía interna, U, tiene un significado físico exacto, es la suma de todas las energías cinéticas y potenciales de todas las partículas en el sistema. El segundo término es la cantidad de transferencia de energía espontánea, TS, donde S es la entropía final del sistema. Para un proceso de temperatura constante, la energía libre de Helmholtz proporciona todo el trabajo reversible. Cuando un físico dice “energía libre” sin indicar Helmholtz o Gibbs, generalmente significa energía libre de Helmholtz, por otro lado, cuando un químico dice “energía libre”, casi siempre significa energía libre de Gibbs .
Energía libre de Gibbs
En termodinámica, la energía libre de Gibbs es un potencial termodinámico que se define como la entalpía del sistema menos el producto de la temperatura multiplicada por la entropía del sistema. Dado que la entalpía se define como la suma de la energía interna E más el producto de la presión py el volumen V, la energía libre de Gibbs se define como:
El cambio en la energía libre de Gibbs, ΔG , en química, es un parámetro muy útil. Se puede considerar como la cantidad máxima de trabajo que se puede obtener de una reacción.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.