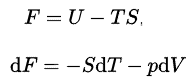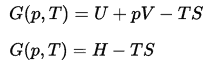Potentiels Thermodynamiques
Les potentiels thermodynamiques sont des quantités scalaires utilisées pour représenter des fonctions d’état. Avec les équations d’état correspondantes, les potentiels thermodynamiques décrivent le comportement à l’équilibre d’un système en fonction de ce que l’on appelle les «variables naturelles».
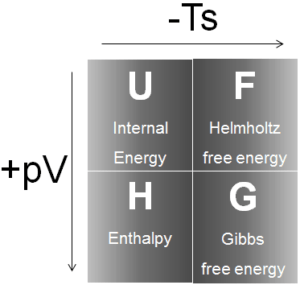
Les quatre potentiels thermodynamiques courants sont:
Énergie interne
En thermodynamique, l’énergie interne (également appelée énergie thermique ) est définie comme l’énergie associée aux formes d’énergie microscopiques . C’est une quantité considérable , cela dépend de la taille du système ou de la quantité de substance qu’il contient. L’unité SI de l’énergie interne est le joule (J) . C’est l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système. Les formes d’énergie microscopiques incluent celles dues à la rotation , à la vibration, à la translation et aux interactionsparmi les molécules d’une substance. Aucune de ces formes d’énergie ne peut être mesurée ou évaluée directement, mais des techniques ont été développées pour évaluer l’évolution de la somme totale de toutes ces formes d’énergie microscopiques.
De plus, l’énergie peut être stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Ce stockage d’énergie au niveau atomique inclut l’énergie associée aux états orbitaux des électrons, au spin nucléaire et aux forces de liaison dans le noyau.
Enthalpie
En thermodynamique, l’ enthalpie est une mesure d’énergie dans un système thermodynamique. C’est la quantité thermodynamique équivalente au contenu thermique total d’un système. L’ enthalpie est définie comme étant la somme de l’énergie interne E plus le produit de la pression p et du volume V. Dans de nombreuses analyses thermodynamiques, la somme de l’énergie interne U et du produit de la pression p et du volume V apparaît. donner à la combinaison un nom, une enthalpie et un symbole distinct, H.
H = U + pV
L’enthalpie est l’expression préférée des changements d’énergie du système dans de nombreuses mesures chimiques, biologiques et physiques à pression constante . Il est si utile qu’il soit présenté dans les tableaux de vapeur avec un volume et une énergie interne spécifiques . Cela est dû au fait que cela simplifie la description du transfert d’énergie . À pression constante, le changement d’enthalpie est égal à l’énergie transférée de l’environnement par le chauffage (Q = H 2 – H 1 ) ou par des travaux autres que des travaux d’expansion. Pour un procédé à pression variable, la différence d’enthalpie n’est pas aussi évidente.
Helmholtz Free Energy
En thermodynamique, l’ énergie libre de Helmholtz est un potentiel thermodynamique qui est défini comme l’ énergie interne du système moins le produit de la température multipliée par l’ entropie du système. il mesure le travail «utile» pouvant être obtenu à partir d’un système thermodynamique fermé à volume et pression constants. L’énergie libre de Helmhotz est définie comme:
L’énergie interne, U, a une signification physique exacte, c’est la somme de toutes les énergies cinétiques et potentielles de toutes les particules du système. Le deuxième terme est la quantité de transfert d’énergie spontanée, TS, où S est l’entropie finale du système. Pour un processus à température constante, l’énergie libre Helmholtz donne tout le travail réversible. Quand un physicien dit «énergie libre» sans indiquer Helmholtz ou Gibbs, cela signifie généralement énergie libre Helmholtz, d’autre part, quand un chimiste dit «énergie libre», il signifie presque toujours énergie libre Gibbs .
Gibbs Free Energy
En thermodynamique, l’ énergie libre de Gibbs est un potentiel thermodynamique qui est défini comme l’ enthalpie du système moins le produit de la température multiplié par l’ entropie du système. Puisque l’ enthalpie est définie comme étant la somme de l’énergie interne E plus le produit de la pression p et du volume V, l’énergie libre de Gibbs est définie comme:
Le changement dans l’énergie libre de Gibbs, ΔG , en chimie, est un paramètre très utile. Il peut être considéré comme la quantité maximale de travail pouvant être obtenue d’une réaction.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci