Sublimação
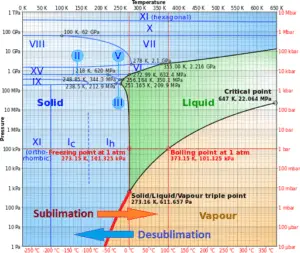
Em geral, a sublimação é uma mudança de fase de uma substância diretamente da fase sólida para a fase gasosa sem passar pela fase líquida intermediária. A sublimação é uma alteração de fase endotérmica que ocorre a temperaturas e pressões abaixo do ponto triplo de uma substância em seu diagrama de fases.
Considere o gelo a -10 ° C e à pressão de 500 Pa. Nesse caso, a transferência de calor para o gelo resulta primeiro em um aumento da temperatura para -8 ° C. Nesse ponto, no entanto, o gelo passa diretamente da fase sólida para a fase de vapor no processo conhecido como sublimação. O calor correspondente é chamado de calor da sublimação , L s . Transferência de calor adicional resultaria no superaquecimento do vapor.
Como a sublimação é uma mudança de fase endotérmica, requer energia adicional. Essa energia adicional necessária pode ser calculada adicionando a entalpia de fusão e a entalpia de vaporização e é conhecida como entalpia de sublimação (também chamada de calor de sublimação).
Para algumas substâncias, a sublimação é muito mais fácil do que a evaporação do fundido. Depende do ponto triplo. Quando a pressão do seu ponto triplo é muito alta, é difícil obtê-los como líquidos.
O processo inverso de sublimação é a sublimação, na qual uma substância passa diretamente de um gás para uma fase sólida.