Saturation
 En thermodynamique, le terme saturation définit une condition dans laquelle un mélange de vapeur et de liquide peut exister ensemble à une température et une pression données. La température à laquelle la vaporisation (ébullition) commence à se produire pour une pression donnée est appelée température de saturation ou point d’ébullition . La pression à laquelle la vaporisation (ébullition) commence à se produire pour une température donnée s’appelle la pression de saturation.
En thermodynamique, le terme saturation définit une condition dans laquelle un mélange de vapeur et de liquide peut exister ensemble à une température et une pression données. La température à laquelle la vaporisation (ébullition) commence à se produire pour une pression donnée est appelée température de saturation ou point d’ébullition . La pression à laquelle la vaporisation (ébullition) commence à se produire pour une température donnée s’appelle la pression de saturation.
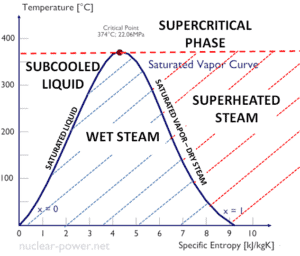
Lorsque la qualité de la vapeur est égale à 0, on parle d’ état de liquide saturé (monophasé). Par ailleurs, lorsque la qualité de la vapeur est égale à 1, on parle d’ état de vapeur saturé ou de vapeur sèche (monophasée). Entre ces deux états, on parle de mélange vapeur-liquide ou vapeur humide ( mélange à deux phases). À pression constante, un apport d’énergie ne modifie pas la température du mélange, mais la qualité de la vapeur et le volume spécifique changent.
Par exemple: Dans le pressuriseur des réacteurs à eau sous pression, la température de saturation est d’environ 350 ° C, mais cela correspond à la pression de 16,4 MPa, qui doit être maintenue dans le circuit primaire. Pour une substance pure, il existe une relation définie entre la pression de saturation et la température de saturation. Plus la pression est élevée, plus la température de saturation est élevée. La représentation graphique de cette relation entre la température et la pression dans des conditions saturées s’appelle la courbe de pression de vapeur et elle peut être vue sur le diagramme de phase de l’eau . Ce diagramme est illustré dans la figure.
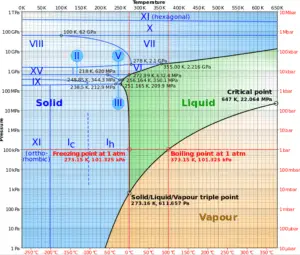
Source: wikipedia.org CC BY-SA
Comme on peut le voir sur le diagramme de phase de l’eau, dans les régions à deux phases (par exemple à la frontière des phases vapeur / liquide), la spécification de la température seule définira la pression et la pression spécifie la température.
- La courbe de vapeur saturante est la courbe séparant l’ état biphasique et l’ état de vapeur surchauffée dans le diagramme Ts.
- La courbe de liquide saturé est la courbe séparant l’ état liquide sous – refroidi et l’ état biphasé dans le diagramme Ts.
Enthalpie spécifique de vapeur humide
L’ enthalpie spécifique de l’eau liquide saturée (x = 0) et de la vapeur sèche (x = 1) peut être choisie dans les tables de vapeur. En cas de vapeur humide , l’enthalpie réelle peut être calculée avec la qualité de la vapeur, x, et les enthalpies spécifiques de l’eau liquide saturée et de la vapeur sèche:
h humide = h s x + (1 – x) h l
où
h humide = enthalpie de vapeur humide (J / kg)
h s = enthalpie de vapeur «sèche» (J / kg)
h l = enthalpie de l’eau liquide saturée (J / kg)
Comme on peut le voir, la vapeur humide aura toujours une enthalpie plus faible que la vapeur sèche.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci