Sublimation
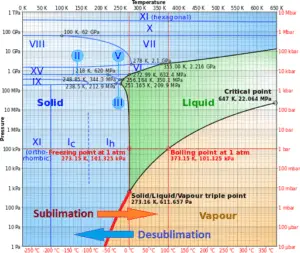
En général, la sublimation est un changement de phase d’une substance directement de la phase solide à la phase gazeuse sans passer par la phase liquide intermédiaire. La sublimation est un changement de phase endothermique qui se produit à des températures et à des pressions inférieures au point triple d’une substance dans son diagramme de phases.
Considérez la glace à -10 ° C et à une pression de 500 Pa. Dans ce cas, le transfert de chaleur à la glace entraîne d’abord une augmentation de la température à -8 ° C. À ce stade, cependant, la glace passe directement de la phase solide à la phase vapeur dans le processus appelé sublimation. La chaleur correspondante est appelée chaleur de sublimation , L s . Un transfert de chaleur supplémentaire entraînerait une surchauffe de la vapeur.
Comme la sublimation est un changement de phase endothermique, elle nécessite de l’énergie supplémentaire. Cette énergie supplémentaire nécessaire peut être calculée en ajoutant l’ enthalpie de fusion et l’ enthalpie de vaporisation . Elle est appelée enthalpie de sublimation (également appelée chaleur de sublimation).
Pour certaines substances, la sublimation est beaucoup plus facile que l’évaporation à l’état fondu. Cela dépend de leur triple point. Lorsque la pression de son point triple est trop élevée, il est difficile de les obtenir sous forme de liquide.
Le processus inverse de la sublimation est la désublimation, dans laquelle une substance passe directement d’un gaz à une phase solide.