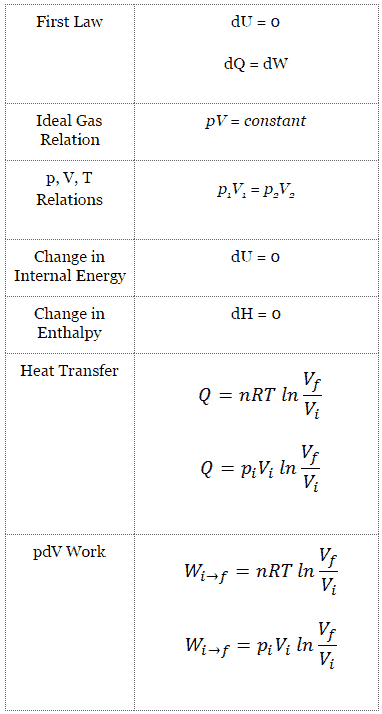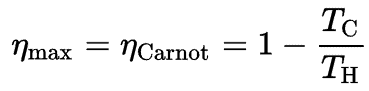Carnot Cycle – Carnot Wärmekraftmaschine
Der zweite Hauptsatz der Thermodynamik schränkt die Richtung der Wärmeübertragung ein und setzt der Effizienz der Umwandlung von Wärme in Arbeit in Wärmekraftmaschinen eine Obergrenze . Das zweite Gesetz ist also für viele wichtige praktische Probleme direkt relevant.
Nicolas Léonard Sadi Carnot , ein französischer Ingenieur und Physiker, hat 1824 die Erforschung des zweiten Gesetzes vorangetrieben, indem er ein Prinzip (auch Carnot-Regel genannt ) formulierte , das Grenzen für den maximalen Wirkungsgrad festlegt, den eine Wärmekraftmaschine erreichen kann. Kurz gesagt, dieses Prinzip besagt, dass der Wirkungsgrad eines thermodynamischen Kreislaufs ausschließlich von der Differenz zwischen dem heißen und dem kalten Temperaturspeicher abhängt.
Das Carnotsche Prinzip besagt:
- Kein Motor kann effizienter sein als ein umkehrbarer Motor ( ein Carnot-Wärmemotor ), der zwischen denselben Hochtemperatur- und Niedertemperaturbehältern betrieben wird.
- Die Wirkungsgrade aller reversiblen Motoren ( Carnot-Wärmekraftmaschinen ), die zwischen denselben Behältern mit konstanter Temperatur betrieben werden, sind unabhängig von der verwendeten Arbeitssubstanz oder den Betriebsdetails gleich.
Der Zyklus dieses Motors wird als Carnot-Zyklus bezeichnet . Ein System, das einen Carnot-Zyklus durchläuft, wird als Carnot-Wärmekraftmaschine bezeichnet . Es ist kein tatsächlicher thermodynamischer Zyklus, sondern ein theoretisches Konstrukt, das in der Praxis nicht erstellt werden kann. Alle realen thermodynamischen Prozesse sind irgendwie irreversibel . Sie werden nicht unendlich langsam ausgeführt und unendlich kleine Temperaturschritte sind ebenfalls eine theoretische Fiktion. Daher müssen Wärmekraftmaschinen aufgrund der inhärenten Irreversibilität des von ihnen verwendeten Wärmekraftmaschinenkreislaufs niedrigere Wirkungsgrade als Grenzen ihres Wirkungsgrades aufweisen.
Carnot-Zyklus – Prozesse
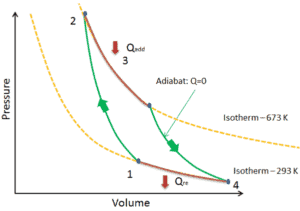
 In einem Carnot- Zyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier intern reversiblen Prozessen : Zwei isentrope Prozesse (reversibel adiabatisch) wechseln sich mit zwei isothermen Prozessen ab :
In einem Carnot- Zyklus durchläuft das System, das den Zyklus ausführt, eine Reihe von vier intern reversiblen Prozessen : Zwei isentrope Prozesse (reversibel adiabatisch) wechseln sich mit zwei isothermen Prozessen ab :
- isentropische Kompression – Das Gas wird adiabatisch von Zustand 1 nach Zustand 2 komprimiert, wo die Temperatur T H beträgt . Die Umgebung arbeitet am Gas, erhöht seine innere Energie und komprimiert es. Andererseits bleibt die Entropie unverändert .
- Isothermische Expansion – Das System ist in Kontakt mit dem Reservoir an platziert T H . Das Gas dehnt sich isotherm aus, während es durch Wärmeübertragung Energie Q H aus dem heißen Speicher empfängt . Die Temperatur des Gases ändert sich während des Prozesses nicht. Das Gas wirkt auf die Umgebung. Die gesamte Entropieänderung ist gegeben durch: ∆S = S 1 – S 4 = Q H / T H.
- isentropische Expansion – Das Gas expandiert adiabatisch von Zustand 3 zu Zustand 4, wo die Temperatur T C beträgt . Das Gas wirkt auf die Umgebung und verliert eine Menge an interner Energie, die der Arbeit entspricht, die das System verlässt. Auch hier bleibt die Entropie unverändert.
- isotherme Kompression – Das System wird bei T C in Kontakt mit dem Reservoir gebracht . Das Gas komprimiert isotherm in seinen Ausgangszustand, während es durch Wärmeübertragung Energie Q C an den Kältespeicher abgibt. Dabei arbeitet die Umgebung am Gas. Die gesamte Entropieänderung ist gegeben durch: ∆S = S 3 – S 2 = Q C / T C.
Isentropischer Prozess
Ein isentropischer Prozess ist ein thermodynamischer Prozess , bei dem die Entropie des Fluids oder Gases konstant bleibt. Dies bedeutet, dass der isentrope Prozess ein Sonderfall eines adiabatischen Prozesses ist, bei dem keine Wärme- oder Materieübertragung stattfindet. Es ist ein reversibler adiabatischer Prozess . Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können .
Isentropischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
oder
dH = TdS + Vdp
Isentropischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ideales Gas )
Isentropischer Prozess des idealen Gases
Der isentrope Prozess (ein Sonderfall des adiabatischen Prozesses) kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV κ = konstant
oder
p 1 V 1 κ = p 2 V 2 κ
wobei κ = c p / c v das Verhältnis der spezifischen Wärme (oder Wärmekapazitäten ) für das Gas ist. Eine für konstanten Druck (c p ) und eine für konstantes Volumen (c v ) . Es ist zu beachten, dass dieses Verhältnis κ = c p / c v ein Faktor bei der Bestimmung der Schallgeschwindigkeit in einem Gas und anderen adiabatischen Prozessen ist.
Isothermer Prozess
Ein isothermer Prozess ist ein thermodynamischer Prozess , bei dem die Temperatur des Systems konstant bleibt (T = const). Die Wärmeübertragung in oder aus dem System muss typischerweise mit einer so langsamen Geschwindigkeit erfolgen, um sich durch Wärmeaustausch kontinuierlich an die Temperatur des Reservoirs anzupassen. In jedem dieser Zustände bleibt das thermische Gleichgewicht erhalten.
Isothermer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit .
Bei isothermen Prozessen und dem idealen Gas wird die gesamte dem System zugeführte Wärme für folgende Arbeiten verwendet:
Isothermer Prozess (dU = 0):
dU = 0 = Q – W → W = Q (für ideales Gas)
Isothermer Prozess des idealen Gases
Der isotherme Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV = konstant
oder
p 1 V 1 = p 2 V 2
Auf einem pV – Diagramm, tritt der Prozess entlang einer Linie (eine Isotherme genannt), die die Gleichung hat p = constant / V .
Siehe auch: Boyle-Mariotte-Gesetz
Carnot-Zyklus – pV, Ts-Diagramm
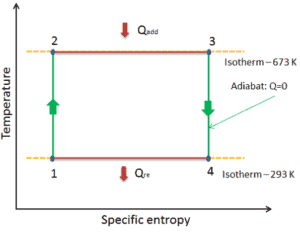
Der Carnot-Zyklus wird häufig in einem Druck-Volumen-Diagramm ( pV-Diagramm ) und in einem Temperatur-Entropie-Diagramm ( Ts-Diagramm ) aufgezeichnet .
In einem Druck-Volumen-Diagramm dargestellt , folgen die isothermen Prozesse den Isothermenlinien für das Gas, adiabatische Prozesse bewegen sich zwischen Isothermen und der durch den gesamten Zyklusweg begrenzte Bereich repräsentiert die Gesamtarbeit, die während eines Zyklus ausgeführt werden kann.
Das Temperatur-Entropie-Diagramm (Ts-Diagramm), in dem der thermodynamische Zustand durch einen Punkt in einem Diagramm mit spezifischen Entropien als horizontale Achse und absoluter Temperatur (T) als vertikaler Achse angegeben wird, ist das beste Diagramm zur Beschreibung des Verhaltens eines Carnot-Zyklus .
Es ist ein nützliches und allgemeines Werkzeug, insbesondere weil es hilft, die Wärmeübertragung während eines Prozesses zu visualisieren. Bei reversiblen (idealen) Prozessen ist die Fläche unter der Ts-Kurve eines Prozesses die Wärme, die während dieses Prozesses auf das System übertragen wird.
Carnot-Zyklus-Effizienz
Im Allgemeinen ist die thermische Effizienz , η th , ein Wärmekraftmaschine ist als das Verhältnis der Netto – definierten Arbeit es tut, W , an den Wärmeeingang bei der hohen Temperatur, Q H .
Da Energie nach dem ersten Hauptsatz der Thermodynamik eingespart wird und Energie nicht vollständig in Arbeit umgewandelt werden kann , muss der Wärmeeintrag Q H gleich der geleisteten Arbeit W plus der Wärme sein, die als Abwärme Q C an die abgegeben werden muss Umgebung. Daher können wir die Formel für den thermischen Wirkungsgrad wie folgt umschreiben:
Da Q C = ∆ST C und Q H = ∆ST H ist , lautet die Formel für diesen maximalen Wirkungsgrad:
wo:
- ist der Wirkungsgrad des Carnot-Zyklus, dh das Verhältnis = W / Q H der vom Motor geleisteten Arbeit zur Wärmeenergie, die aus dem heißen Speicher in das System gelangt.
- T C ist die absolute Temperatur (Kelvin) des kalten Reservoirs,
- T H ist die absolute Temperatur (Kelvin) des heißen Reservoirs.
Siehe auch: Ursachen für Ineffizienzen
Beispiel: Carnot-Effizienz für Kohlekraftwerk
In einem modernen Kohlekraftwerk würde die Temperatur von Hochdruckdampf (T heiß ) etwa 400 ° C (673 K) und T kalt , die Wassertemperatur des Kühlturms, etwa 20 ° C (293 K) betragen. Für diesen Kraftwerkstyp beträgt der maximale (ideale) Wirkungsgrad:
η th = 1 – T kalt / T heiß = 1 – 293/673 = 56%
Es muss hinzugefügt werden, dies ist eine idealisierte Effizienz . Die Carnot-Effizienz gilt für reversible Prozesse. Diese Prozesse können in realen Kraftwerkszyklen nicht erreicht werden. Der Carnot-Wirkungsgrad schreibt vor, dass durch Erhöhen der Dampftemperatur höhere Wirkungsgrade erzielt werden können. Diese Funktion gilt auch für reale thermodynamische Zyklen. Dies erfordert jedoch einen Druckanstieg in Kesseln oder Dampferzeugern . Metallurgische Überlegungen begrenzen solche Drücke jedoch. Unterkritische Kraftwerke mit fossilen Brennstoffen, die unter kritischem Druck (dh unter 22,1 MPa) betrieben werden, können einen Wirkungsgrad von 36–40% erreichen. Überkritische Konstruktionen, die bei überkritischem Druck betrieben werden(dh größer als 22,1 MPa) haben Wirkungsgrade um 43%. Die effizientesten und auch sehr komplexen Kohlekraftwerke, die bei „extrem kritischen“ Drücken (dh etwa 30 MPa) betrieben werden und eine mehrstufige Wiedererwärmung verwenden, erreichen einen Wirkungsgrad von etwa 48%.
Siehe auch: Überkritischer Reaktor
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.