Isothermer Prozess
Ein isothermer Prozess ist ein thermodynamischer Prozess , bei dem die Temperatur des Systems konstant bleibt (T = const). Die Wärmeübertragung in oder aus dem System muss typischerweise mit einer so langsamen Geschwindigkeit erfolgen, um sich durch Wärmeaustausch kontinuierlich an die Temperatur des Speichers anzupassen. In jedem dieser Zustände bleibt das thermische Gleichgewicht erhalten.
Für ein ideales Gas und einen polytropischen Prozess entspricht der Fall n = 1 einem isothermen Prozess (konstante Temperatur). Im Gegensatz zum adiabatischen Prozess , bei dem n = κ und ein System keine Wärme mit seiner Umgebung austauscht (Q = 0; ∆T ≠ 0 ) , ändert sich bei einem isothermen Prozess die innere Energie nicht (aufgrund von ∆T = 0) ) und daher ΔU = 0 (für ideale Gase) und Q ≠ 0. Ein adiabatischer Prozess ist nicht notwendigerweise ein isothermer Prozess, noch ist ein isothermer Prozess notwendigerweise adiabatisch.
In der Technik sind Phasenänderungen wie Verdampfung oder Schmelzen isotherme Prozesse, wenn sie wie gewöhnlich bei konstantem Druck und konstanter Temperatur auftreten.
Isothermer Prozess und das erste Gesetz
Die klassische Form des ersten Hauptsatzes der Thermodynamik ist die folgende Gleichung:
dU = dQ – dW
In dieser Gleichung ist dW gleich dW = pdV und ist bekannt als die Grenz Arbeit .
Bei isothermen Prozessen und dem idealen Gas wird die gesamte dem System zugeführte Wärme für folgende Arbeiten verwendet:
Isothermer Prozess (dU = 0):
dU = 0 = Q – W → W = Q (für ideales Gas)
Der isotherme Prozess kann mit dem idealen Gasgesetz ausgedrückt werden als:
pV = konstant
oder
p 1 V 1 = p 2 V 2
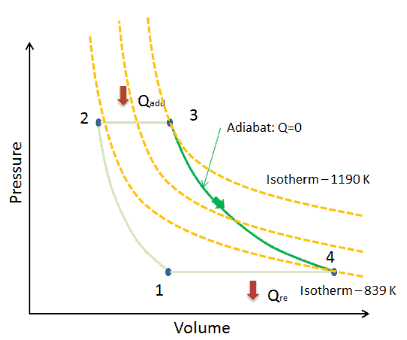
Auf einem pV – Diagramm, tritt der Prozess entlang einer Linie (eine Isotherme genannt), die die Gleichung hat p = constant / V .
Adiabatischer Prozess
Ein adiabatischer Prozess ist ein thermodynamischer Prozess , bei dem keine Wärmeübertragung in das System oder aus dem System erfolgt (Q = 0). Das System kann als perfekt isoliert angesehen werden . In einem adiabatischen Prozess wird Energie nur als Arbeit übertragen. Die Annahme, dass keine Wärmeübertragung stattfindet, ist sehr wichtig, da wir die adiabatische Näherung nur in sehr schnellen Prozessen verwenden können . Bei diesen schnellen Prozessen bleibt nicht genügend Zeit für die Übertragung von Energie als Wärme zum oder vom System.
In realen Geräten (wie Turbinen, Pumpen und Kompressoren) treten Wärmeverluste und Verluste im Verbrennungsprozess auf. Diese Verluste sind jedoch im Vergleich zum Gesamtenergiefluss normalerweise gering, und wir können einige thermodynamische Prozesse durch den adiabatischen Prozess approximieren.
Adiabatischer Prozess und das erste Gesetz
Für ein geschlossenes System können wir den ersten Hauptsatz der Thermodynamik in Bezug auf die Enthalpie schreiben :
dH = dQ + Vdp
In dieser Gleichung ist der Begriff Vdp eine Flussprozessarbeit . Diese Arbeit, Vdp, wird für Open-Flow-Systeme wie eine Turbine oder eine Pumpe verwendet, bei denen ein „dp“ vorliegt, dh eine Druckänderung. Wie zu sehen ist, vereinfacht diese Form des Gesetzes die Beschreibung der Energieübertragung . Im adiabatischen Prozess entspricht die Enthalpieänderung der Flussprozessarbeit, die am oder vom System ausgeführt wird:
Adiabatischer Prozess (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (für ein ideales Gas )
Kostenlose Erweiterung – Joule-Erweiterung
Dies sind adiabatische Prozesse, bei denen keine Wärmeübertragung zwischen dem System und seiner Umgebung stattfindet und keine Arbeiten am oder vom System ausgeführt werden. Diese Arten von adiabatischen Prozessen werden als freie Expansion bezeichnet . Es ist ein irreversibler Prozess, bei dem sich ein Gas in eine isolierte evakuierte Kammer ausdehnt. Es wird auch Joule-Erweiterung genannt . Für ein ideales Gas ändert sich die Temperatur nicht (dies bedeutet, dass der Prozess auch isotherm ist ) , jedoch erfahren echte Gase eine Temperaturänderung während der freien Expansion. Bei der freien Expansion ist Q = W = 0, und das erste Gesetz verlangt Folgendes:
dE int = 0
Eine freie Expansion kann nicht in einem PV-Diagramm dargestellt werden, da der Prozess schnell und nicht quasistatisch ist. Die Zwischenzustände sind keine Gleichgewichtszustände, und daher ist der Druck nicht klar definiert.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.