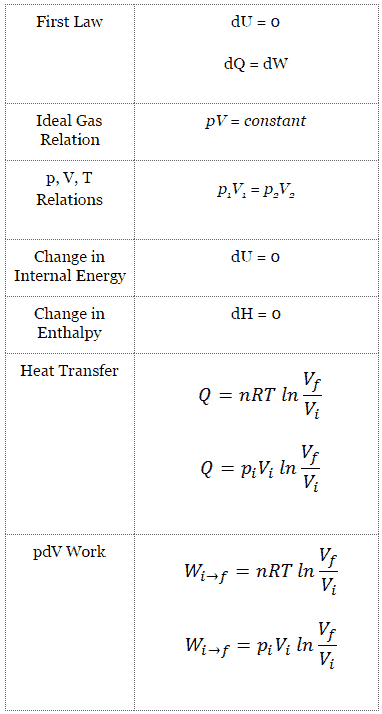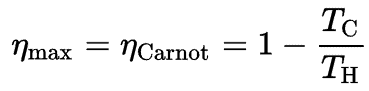Cycle Carnot – Moteur thermique Carnot
La deuxième loi de la thermodynamique impose des contraintes sur la direction du transfert de chaleur et fixe une limite supérieure au rendement de conversion de la chaleur pour fonctionner dans les moteurs thermiques . La seconde loi est donc directement pertinente pour de nombreux problèmes pratiques importants.
En 1824, Nicolas Léonard Sadi Carnot , ingénieur et physicien français, a approfondi l’étude de le deuxième principe en formant un principe (également appelé règle de Carnot ) qui définit les limites d’ efficacité maximum qu’un moteur thermique peut obtenir. En bref, ce principe stipule que l’ efficacité d’un cycle thermodynamique dépend uniquement de la différence entre les réservoirs de température chaud et froid.
Le principe de Carnot est le suivant:
- Aucun moteur ne peut être plus efficace qu’un moteur réversible ( un moteur thermique Carnot ) fonctionnant entre les mêmes réservoirs à haute et à basse température.
- Les rendements de tous les moteurs réversibles (moteurs thermiques Carnot ) fonctionnant entre les mêmes réservoirs à température constante sont les mêmes, quel que soit le principe actif utilisé ou les détails du fonctionnement.
Le cycle de ce moteur s’appelle le cycle Carnot . Un système en cycle Carnot est appelé moteur thermique Carnot . Ce n’est pas un cycle thermodynamique réel, mais un construit théorique et ne peut pas être construit dans la pratique. Tous les processus thermodynamiques réels sont en quelque sorte irréversibles . Ils ne se font pas à l’ infini lentement et l’ infiniment petit pas en température est aussi une fiction théorique. Par conséquent, les moteurs thermiques doivent avoir des rendements inférieurs aux limites fixées en raison de l’irréversibilité inhérente du cycle de moteur thermique qu’ils utilisent.
Cycle de Carnot – Processus
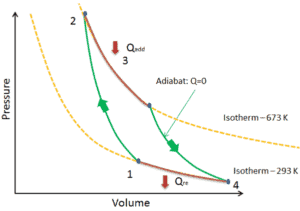
 Dans un cycle de Carnot , le système exécutant le cycle subit une série de quatre processus réversibles en interne : deux processus isentropiques (adiabatiques réversibles) alternés avec deux processus isothermes :
Dans un cycle de Carnot , le système exécutant le cycle subit une série de quatre processus réversibles en interne : deux processus isentropiques (adiabatiques réversibles) alternés avec deux processus isothermes :
- compression isentropique – Le gaz est comprimé de manière adiabatique de l’ état 1 à l’ état 2, où la température est T H . Les environs agissent sur le gaz, augmentant son énergie interne et le compressant. En revanche, l’ entropie reste inchangée .
- Détente isotherme – Le système est placé en contact avec le réservoir à T H . Le gaz se dilate de manière isotherme tout en recevant l’énergie Q H du réservoir chaud par transfert de chaleur. La température du gaz ne change pas pendant le processus. Le gaz fonctionne sur l’environnement. Le changement d’entropie total est donné par: ∆S = S 1 – S 4 = Q H / T H
- détente isentropique – le gaz se détend adiabatiquement de l’ état 3 à l’ état 4, où la température est T C . Le gaz travaille sur l’environnement et perd une quantité d’énergie interne égale au travail qui quitte le système. Encore une fois, l’entropie reste inchangée.
- compression isotherme – Le système est placé en contact avec le réservoir à T C . Le gaz se comprime de manière isotherme à son état initial tandis qu’il décharge l’énergie Q C dans le réservoir froid par transfert de chaleur. Dans ce processus, l’environnement travaille sur le gaz. Le changement d’entropie total est donné par: ∆S = S 3 – S 2 = Q C / T C
Processus isentropique
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropie du fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides .
Processus isentropique et première loi
Pour un système fermé, on peut écrire la première loi de la thermodynamique en termes d’enthalpie :
dH = dQ + Vdp
ou
dH = TdS + Vdp
Processus isentropique (dQ = 0):
dH = Vdp → W = H 2 – H 1 → H 2 – H 1 = C p (T 2 – T 1 ) (pour le gaz parfait )
Processus isentropique du gaz parfait
Le processus isentropique (un cas particulier du processus adiabatique) peut être exprimé avec la loi du gaz parfait comme:
pV κ = constant
ou
p 1 V 1 κ = p 2 V 2 κ
dans laquelle κ = c p / c v est le rapport des chaleurs spécifiques (ou capacités calorifiques ) pour le gaz. Un pour une pression constante (c p ) et un pour un volume constant (c v ) . Notez que ce rapport κ = c p / c v est un facteur déterminant la vitesse du son dans un gaz et d’autres processus adiabatiques.
Processus isotherme
Un processus isotherme est un processus thermodynamique , dans lequel la température du système reste constante (T = const). Le transfert de chaleur dans ou hors du système doit généralement se produire à un rythme aussi lent afin de s’adapter en permanence à la température du réservoir par échange de chaleur. Dans chacun de ces états, l’ équilibre thermique est maintenu.
Processus isotherme et première loi
La forme classique de la première loi de la thermodynamique est l’équation suivante:
dU = dQ – dW
Dans cette équation, dW est égal à dW = pdV et est connu comme le travail aux limites .
Dans le processus isotherme et le gaz parfait , toute la chaleur ajoutée au système sera utilisée pour effectuer les travaux:
Processus isotherme (dU = 0):
dU = 0 = Q – W → W = Q (pour le gaz parfait)
Processus isotherme du gaz parfait
Le processus isotherme peut s’exprimer avec la loi du gaz parfait comme:
pV = constant
ou
p 1 V 1 = p 2 V 2
Sur un diagramme pV, le processus se produit le long d’ une ligne (appelée isotherme) qui a l’équation p = constante / V .
Voir aussi: loi de Boyle-Mariotte
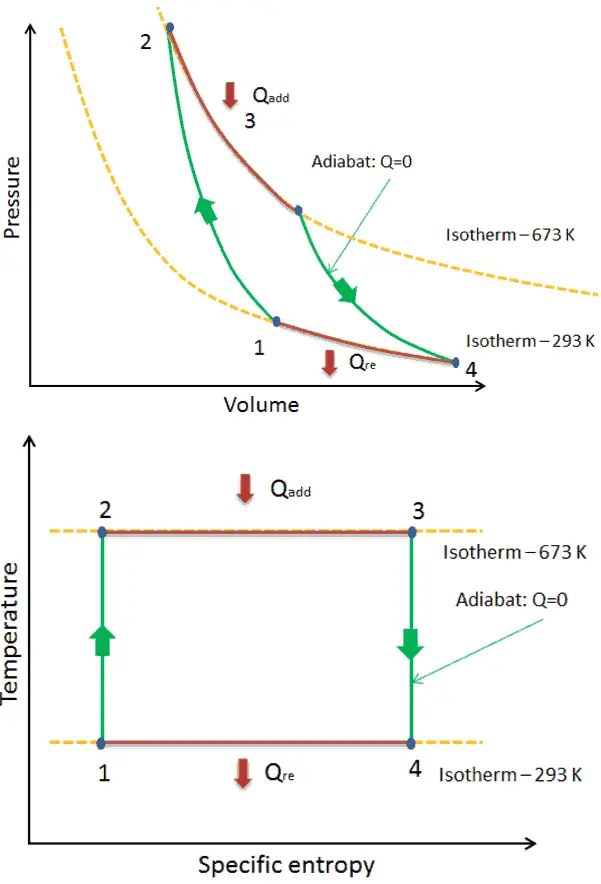
Cycle de Carnot – diagramme pV, Ts
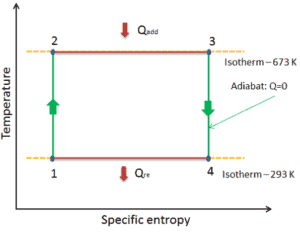
Le cycle de Carnot est souvent tracé sur un diagramme pression-volume ( diagramme pV ) et sur un diagramme température-entropie ( diagramme Ts ).
Lorsqu’ils sont tracés sur un diagramme pression-volume , les processus isothermes suivent les lignes isothermes pour le gaz, les processus adiabatiques se déplacent entre les isothermes et la zone délimitée par la piste cyclable complète représente le travail total qui peut être effectué pendant un cycle.
Le diagramme température-entropie ( diagramme Ts) dans lequel l’état thermodynamique est spécifié par un point sur un graphique avec une ou des entropies spécifiques comme axe horizontal et une température absolue (T) comme axe vertical, est le meilleur diagramme pour décrire le comportement d’un cycle de Carnot .
C’est un outil utile et courant, notamment parce qu’il permet de visualiser le transfert de chaleur au cours d’un processus. Pour les processus réversibles (idéaux), l’aire sous la courbe Ts d’un processus est la chaleur transférée au système pendant ce processus.
Efficacité du cycle Carnot
En général, le rendement thermique , η e , d’un moteur thermique est définie comme étant le rapport du filet travail qu’il fait, W , à la chaleur d’ entrée à la température élevée, Q H .
Puisque l’énergie est conservée selon la première loi de la thermodynamique et que l’énergie ne peut pas être convertie pour fonctionner complètement, l’apport de chaleur, Q H , doit être égal au travail effectué, W, plus la chaleur qui doit être dissipée sous forme de chaleur résiduelle Q C dans le environnement. Par conséquent, nous pouvons réécrire la formule de l’efficacité thermique comme suit:
Puisque Q C = ∆ST C et Q H = ∆ST H , la formule de cette efficacité maximale est:
où:
- est l’efficacité du cycle de Carnot, c’est-à-dire le rapport = W / Q H du travail effectué par le moteur sur l’énergie thermique entrant dans le système depuis le réservoir chaud.
- T C est la température absolue (Kelvins) du réservoir froid,
- T H est la température absolue (Kelvins) du réservoir chaud.
Voir aussi: Causes des inefficacités
Exemple: efficacité de Carnot pour une centrale au charbon
Dans une centrale électrique au charbon moderne , la température de la vapeur à haute pression (T chaud ) serait d’environ 400 ° C (673 K) et T froide , la température de l’eau de la tour de refroidissement, serait d’environ 20 ° C (293 K). Pour ce type de centrale, l’efficacité maximale (idéale) sera:
η th = 1 – T froid / T chaud = 1 – 293/673 = 56%
Il faut l’ajouter, c’est une efficacité idéalisée . L’efficacité Carnot est valable pour les procédés réversibles. Ces processus ne peuvent pas être réalisés dans les cycles réels des centrales électriques. L’efficacité Carnot dicte que des rendements plus élevés peuvent être atteints en augmentant la température de la vapeur. Cette fonctionnalité est également valable pour les cycles thermodynamiques réels. Mais cela nécessite une augmentation des pressions à l’intérieur des chaudières ou des générateurs de vapeur . Cependant, des considérations métallurgiques imposent des limites supérieures à ces pressions. Les centrales électriques à combustibles fossiles sous-critiques, qui fonctionnent sous une pression critique (c’est-à-dire inférieure à 22,1 MPa), peuvent atteindre une efficacité de 36 à 40%. Conceptions supercritiques, qui fonctionnent à pression supercritique(c’est-à-dire supérieure à 22,1 MPa), ont des rendements d’environ 43%. Les centrales au charbon les plus efficaces et les plus complexes qui fonctionnent à des pressions «ultra critiques» (soit environ 30 MPa) et utilisent un réchauffage à plusieurs étages atteignent une efficacité d’environ 48%.
Voir aussi: Réacteur supercritique
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci