Innere Energie eines idealen Gases
Monatomisches Gas
Für ein einatomiges ideales Gas (wie Helium, Neon oder Argon) kommt der einzige Beitrag zur Energie von der translatorischen kinetischen Energie . Die durchschnittliche translatorische kinetische Energie eines einzelnen Atoms hängt nur von der Gastemperatur ab und ist durch die Gleichung gegeben
K avg = 3/2 kT.
Die innere Energie von n Mol eines idealen einatomigen Gases (ein Atom pro Molekül) entspricht der durchschnittlichen kinetischen Energie pro Molekül multipliziert mit der Gesamtzahl der Moleküle, N:
E int = 3/2 NkT = 3/2 nRT
Dabei ist n die Anzahl der Mol. Jede Richtung (x, y und z) trägt (1/2) nRT zur inneren Energie bei. Hier kommt die Aufteilung der Energieidee ins Spiel – jeder andere Beitrag zur Energie muss ebenfalls (1/2) nRT beitragen. Wie zu sehen ist, hängt die innere Energie eines idealen Gases nur von der Temperatur und der Anzahl der Mol Gas ab.
Diatomeenmolekül
Wenn die Gasmoleküle mehr als ein Atom enthalten, gibt es drei Translationsrichtungen , und die kinetische Rotationsenergie trägt ebenfalls dazu bei, jedoch nur für Rotationen um zwei der drei senkrechten Achsen. Die fünf Beiträge zur Energie (fünf Freiheitsgrade) ergeben:
Diatomeen-Idealgas:
E int = (5/2) NkT = (5/2) nRT
Dies ist nur eine Annäherung und gilt bei Zwischentemperaturen. Bei niedrigen Temperaturen trägt nur die translatorische kinetische Energie bei, und bei höheren Temperaturen kommen zwei zusätzliche Beiträge (kinetische und potentielle Energie) durch Vibration.
Die innere Energie ist bei einer gegebenen Temperatur größer als bei einem einatomigen Gas, aber sie ist immer noch nur eine Funktion der Temperatur für ein ideales Gas.
Die innere Energie realer Gase hängt ebenfalls hauptsächlich von der Temperatur ab, aber ähnlich wie das ideale Gasgesetz hängt die innere Energie realer Gase auch etwas von Druck und Volumen ab. Alle realen Gase nähern sich bei niedrigen Drücken (Dichten) dem Idealzustand. Bei niedrigen Drücken sind Moleküle weit genug voneinander entfernt, dass sie nicht miteinander interagieren. Die innere Energie von Flüssigkeiten und Festkörpern ist ziemlich kompliziert, da sie elektrische potentielle Energie enthält, die mit den Kräften (oder „chemischen“ Bindungen) zwischen Atomen und Molekülen verbunden ist.
Joules zweites Gesetz
Für jedes Gas, dessen Zustandsgleichung genau durch pV = nRT (oder pv = RT) gegeben ist, hängt die spezifische innere Energie nur von der Temperatur ab. Diese Regel wurde ursprünglich 1843 von Joule experimentell für reale Gase gefunden und ist als Joules zweites Gesetz bekannt :
Die innere Energie einer festen Masse eines idealen Gases hängt nur von seiner Temperatur ab (nicht von Druck oder Volumen).
Die durch pV = nRT beschriebene spezifische Enthalpie eines Gases hängt ebenfalls nur von der Temperatur ab. Beachten Sie, dass die Enthalpie die thermodynamische Größe ist, die dem Gesamtwärmegehalt eines Systems entspricht. Sie entspricht der inneren Energie des Systems plus dem Produkt aus Druck und Volumen. In intensiven Variablen ist das zweite Gesetz von Joule daher gegeben durch h = h (T) = u (T) + pv = u (T) + RT .
Diese drei Gleichungen bilden das ideale Gasmodell, zusammengefasst wie folgt:
pv = RT
u = u (T)
h = h (T) = u (T) + RT
Mikroskopische Energie
Interne Energie beinhaltet Energie im mikroskopischen Maßstab . Es kann in mikroskopische potentielle Energie, U- Pot und mikroskopische kinetische Energie, U- Kin , Komponenten unterteilt werden:
U = U Topf + U Kin
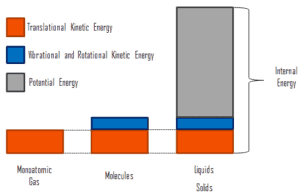 wobei die mikroskopische kinetische Energie U kin die Bewegungen aller Partikel des Systems in Bezug auf den Schwerpunktrahmen umfasst. Für ein ideales einatomiges Gas ist dies nur die translatorische kinetische Energie der linearen Bewegung der Atome. Monoatomare Partikel drehen oder vibrieren nicht. Das Verhalten des Systems wird durch die kinetische Theorie der Gase gut beschrieben. Die kinetische Theorie basiert auf der Tatsache, dass während einer elastischen Kollision zwischen einem Molekül mit hoher kinetischer Energie und einem Molekül mit niedriger kinetischer Energie ein Teil der Energie auf das Molekül mit niedriger kinetischer Energie übertragen wird. Für mehratomige Gase gibt es jedoch Rotations- undauch kinetische Schwingungsenergie .
wobei die mikroskopische kinetische Energie U kin die Bewegungen aller Partikel des Systems in Bezug auf den Schwerpunktrahmen umfasst. Für ein ideales einatomiges Gas ist dies nur die translatorische kinetische Energie der linearen Bewegung der Atome. Monoatomare Partikel drehen oder vibrieren nicht. Das Verhalten des Systems wird durch die kinetische Theorie der Gase gut beschrieben. Die kinetische Theorie basiert auf der Tatsache, dass während einer elastischen Kollision zwischen einem Molekül mit hoher kinetischer Energie und einem Molekül mit niedriger kinetischer Energie ein Teil der Energie auf das Molekül mit niedriger kinetischer Energie übertragen wird. Für mehratomige Gase gibt es jedoch Rotations- undauch kinetische Schwingungsenergie .
Die mikroskopische potentielle Energie U pot beinhaltet die chemischen Bindungen zwischen den Atomen, aus denen die Moleküle bestehen, die Bindungskräfte im Kern und auch die physikalischen Kraftfelder innerhalb des Systems (z. B. elektrische oder magnetische Felder).
In Flüssigkeiten und Feststoffen gibt es einen signifikanten Anteil der potentiellen Energie, die mit den intermolekularen Anziehungskräften verbunden ist .
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.