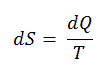Was ist Enthalpie?
In der Thermodynamik ist die Enthalpie das Maß für die Energie in einem thermodynamischen System. Dies ist die thermodynamische Größe, die dem Gesamtwärmegehalt eines Systems entspricht. Die Enthalpie ist definiert als die Summe der inneren Energie E plus des Produkts aus Druck p und Volumen V. In vielen thermodynamischen Analysen erscheint die Summe der inneren Energie U und des Produkts aus Druck p und Volumen V, daher ist es zweckmäßig um der Kombination einen Namen, eine Enthalpie und ein eindeutiges Symbol zu geben, H.
Die Enthalpie ist der bevorzugte Ausdruck von Systemenergieänderungen bei vielen chemischen, biologischen und physikalischen Messungen bei konstantem Druck . Es ist so nützlich, dass es in den Dampftabellen zusammen mit dem spezifischen Volumen und der spezifischen inneren Energie aufgeführt ist . Dies vereinfacht die Beschreibung der Energieübertragung . Bei konstantem Druck entspricht die Enthalpieänderung der Energie, die durch Erhitzen (Q = H 2 – H 1 ) oder andere Arbeiten als Expansionsarbeiten aus der Umgebung übertragen wird . Bei einem Prozess mit variablem Druck ist der Unterschied in der Enthalpie nicht ganz so offensichtlich.
Enthalpie in ausgedehnten Einheiten
H = U + pV
Die Enthalpie ist eine umfangreiche Menge, die von der Größe des Systems oder der Menge der darin enthaltenen Substanz abhängt. Die SI-Einheit der Enthalpie ist das Joule (J). Es ist die im System enthaltene Energie, ausgenommen die kinetische Bewegungsenergie des gesamten Systems und die potentielle Energie des gesamten Systems aufgrund externer Kraftfelder. Dies ist die thermodynamische Größe, die dem Gesamtwärmegehalt eines Systems entspricht.
Andererseits kann Energie in den chemischen Bindungen zwischen den Atomen gespeichert werden, aus denen die Moleküle bestehen. Dieser Energiespeicher auf atomarer Ebene umfasst Energie, die mit Elektronenorbitalzuständen, Kernspin und Bindungskräften im Kern verbunden ist.
Die Enthalpie wird durch das Symbol H dargestellt , und die Änderung der Enthalpie in einem Prozess ist H 2 – H 1 .
Es gibt Ausdrücke in Bezug auf bekanntere Variablen wie Temperatur und Druck :
dH = C p dT + V (1-αT) dp
Dabei ist C p die Wärmekapazität bei konstantem Druck und α der Koeffizient der (kubischen) Wärmeausdehnung. Für ideales Gas ist αT = 1 und daher:
dH = C p dT
Beispiel: Reibungsloser Kolben – Wärme – Enthalpie

Ein reibungsfreier Kolben wird verwendet, um einen konstanten Druck von 500 kPa in einem Zylinder bereitzustellen , der Dampf ( überhitzten Dampf ) mit einem Volumen von 2 m 3 bei 500 K enthält . Berechnen der Endtemperatur, falls 3000 kJ von Wärme hinzugefügt wird.
Lösung:
Anhand von Dampftabellen wissen wir, dass die spezifische Enthalpie eines solchen Dampfes (500 kPa; 500 K) etwa 2912 kJ / kg beträgt . Da der Dampf unter diesen Bedingungen eine Dichte von 2,2 kg / m 3 hat , wissen wir, dass sich bei einer Enthalpie von 2912 kJ / kg x 4,4 kg = 12812 kJ etwa 4,4 kg Dampf im Kolben befinden .
Wenn wir einfach Q = H 2 – H 1 verwenden , ist die resultierende Dampfenthalpie:
H 2 = H 1 + Q = 15812 kJ
Von Dampftabellen , wie Heißdampf (15812 / 4,4 = 3593 kJ / kg) wird eine Temperatur von haben 828 K (555 ° C) . Da der Dampf bei dieser Enthalpie eine Dichte von 1,31 kg / m 3 hat , ist es offensichtlich, dass er sich um etwa 2,2 / 1,31 = 1,67 (+ 67%) ausgedehnt hat. Daher beträgt das resultierende Volumen 2 m 3 × 1,67 = 3,34 m 3 und ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
Der p∆V- Teil der Enthalpie, dh die geleistete Arbeit, ist:
W = p∆V = 500 000 Pa × 1,34 m 3 = 670 kJ
Was ist Entropie?
In der Thermodynamik und statistischen Physik ist die Entropie ein quantitatives Maß für die Störung oder die Energie in einem System, um Arbeit zu leisten.
In der statistischen Physik ist die Entropie ein Maß für die Störung eines Systems. Was bedeutet Unordnung ist wirklich die Anzahl der mikroskopischen Konfigurationen , W , dass ein thermodynamisches System , wenn in einem Zustand von bestimmten makroskopischen Variablen wie angegeben hat ( Volumen , Energie , Druck und Temperatur ). Mit “mikroskopischen Zuständen” meinen wir die genauen Zustände aller Moleküle, aus denen das System besteht.
Mathematisch lautet die genaue Definition:
Entropie = (Boltzmannsche Konstante k) x Logarithmus der Anzahl möglicher Zustände
S = k B logW
Diese Gleichung, die die mikroskopischen Details oder Mikrozustände des Systems (über W ) mit seinem makroskopischen Zustand (über die Entropie S ) in Beziehung setzt , ist die Schlüsselidee der statistischen Mechanik. In einem geschlossenen System nimmt die Entropie niemals ab, so dass die Entropie im Universum irreversibel zunimmt. In einem offenen System (zum Beispiel einem wachsenden Baum) kann die Entropie abnehmen und die Ordnung zunehmen, jedoch nur auf Kosten einer Zunahme der Entropie an einem anderen Ort (z. B. in der Sonne).
Entropieeinheiten
Die SI – Einheit für die Entropie ist J / K . Nach Clausius wurde die Entropie über die Änderung der Entropie S eines Systems definiert. Die Änderung der Entropie S, wenn ihr durch einen reversiblen Prozess bei konstanter Temperatur eine Wärmemenge Q zugesetzt wird, ist gegeben durch:
Hier ist Q die Energie, die während des Prozesses als Wärme zum oder vom System übertragen wird, und T ist die Temperatur des Systems in Kelvin während des Prozesses. Wenn wir einen reversiblen isothermen Prozess annehmen , ist die gesamte Entropieänderung gegeben durch:
∆S = S 2 – S 1 = Q / T.
In dieser Gleichung hängt der Quotient Q / T mit der Zunahme der Störung zusammen. Höhere Temperatur bedeutet größere Zufälligkeit der Bewegung. Bei niedrigeren Temperaturen bewirkt die Zugabe von Wärme Q eine wesentliche fraktionierte Zunahme der molekularen Bewegung und Zufälligkeit. Wenn andererseits die Substanz bereits heiß ist, trägt die gleiche Wärmemenge Q relativ wenig zur größeren molekularen Bewegung bei.
Beispiel
Berechnen Sie die Entropieänderung von 1 kg Eis bei 0 ° C, wenn es bei 0 ° C reversibel zu Wasser geschmolzen wird.
Da es sich um einen isothermen Prozess handelt, können wir Folgendes verwenden:
∆S = S 2 – S 1 = Q / T.
daher wird die Entropieänderung sein:
∆S = 334 [kJ] / 273,15 [K] = 1,22 [kJ / K]
wobei 334 Kilojoule Wärme erforderlich sind, um 1 kg Eis zu schmelzen (latente Schmelzwärme = 334 kJ / kg) und diese Wärme bei 0 ° C (273,15 K) auf das System übertragen wird.
Ts Diagramme
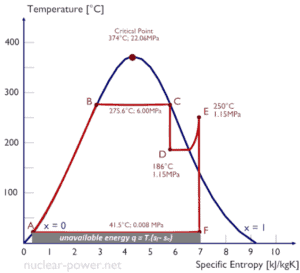
Im Allgemeinen werden die Phasen eines Stoffes und die Beziehungen zwischen seinen Eigenschaften am häufigsten in Eigenschaftsdiagrammen dargestellt . Es wurde eine große Anzahl verschiedener Eigenschaften definiert, und es gibt einige Abhängigkeiten zwischen den Eigenschaften.
Ein Temperatur-Entropie-Diagramm ( Ts-Diagramm ) ist der Diagrammtyp, der am häufigsten zur Analyse von Energieübertragungssystemzyklen verwendet wird. Es wird in der Thermodynamik verwendet, um Änderungen der Temperatur und der spezifischen Entropie während eines thermodynamischen Prozesses oder Zyklus zu visualisieren.
Dies liegt daran , die Arbeit von oder auf dem System und die getan Wärme hinzugefügt oder entfernt aus dem System kann auf dem visualisiert wird Ts Diagramm . Nach der Definition der Entropie entspricht die Wärme, die zu oder von einem System übertragen wird, der Fläche unter der Ts-Kurve des Prozesses.
dQ = TdS
Ein isentropischer Prozess wird in einem Ts-Diagramm als vertikale Linie dargestellt, während ein isothermer Prozess eine horizontale Linie ist. In einem idealisierten Zustand ist die Kompression eine Pumpe, die Kompression in einem Kompressor und die Expansion in einer Turbine sind isentrope Prozesse. Daher ist es in der Energietechnik sehr nützlich, da diese Geräte in thermodynamischen Kreisläufen von Kraftwerken eingesetzt werden.
Beachten Sie, dass die isentropischen Annahmen nur für ideale Kreisprozessen gelten. Reale thermodynamische Kreisprozessen haben inhärente Energieverluste aufgrund der Ineffizienz von Kompressoren und Turbinen.
……………………………………………………………………………………………………………………………….
Dieser Artikel basiert auf der maschinellen Übersetzung des englischen Originalartikels. Weitere Informationen finden Sie im Artikel auf Englisch. Sie können uns helfen. Wenn Sie die Übersetzung korrigieren möchten, senden Sie diese bitte an: translations@nuclear-power.com oder füllen Sie das Online-Übersetzungsformular aus. Wir bedanken uns für Ihre Hilfe und werden die Übersetzung so schnell wie möglich aktualisieren. Danke.