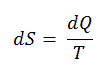Qu’est-ce que l’enthalpie
En thermodynamique, l’enthalpie est la mesure de l’énergie dans un système thermodynamique. Il s’agit de la quantité thermodynamique équivalente au contenu calorifique total d’un système. L’ enthalpie est définie comme étant la somme de l’énergie interne E plus le produit de la pression p et du volume V.Dans de nombreuses analyses thermodynamiques, la somme de l’énergie interne U et du produit de la pression p et du volume V apparaît, il est donc commode pour donner à la combinaison un nom, une enthalpie et un symbole distinct, H.
L’enthalpie est l’expression préférée des changements d’énergie du système dans de nombreuses mesures chimiques, biologiques et physiques à pression constante . Il est si utile qu’il est tabulé dans les tables de vapeur avec un volume spécifique et une énergie interne spécifique . C’est dû au fait, cela simplifie la description du transfert d’énergie . À pression constante, le changement d’enthalpie est égal à l’énergie transférée de l’environnement par le chauffage (Q = H 2 – H 1 ) ou un travail autre que le travail d’expansion. Pour un procédé à pression variable, la différence d’enthalpie n’est pas aussi évidente.
Enthalpie en unités extensives
H = U + pV
L’enthalpie est une quantité importante, elle dépend de la taille du système ou de la quantité de substance qu’il contient. L’unité SI d’enthalpie est le joule (J). Il s’agit de l’énergie contenue dans le système, à l’exclusion de l’énergie cinétique de mouvement du système dans son ensemble et de l’énergie potentielle du système dans son ensemble en raison des champs de force externes. Il s’agit de la quantité thermodynamique équivalente au contenu calorifique total d’un système.
D’un autre côté, l’énergie peut être stockée dans les liaisons chimiques entre les atomes qui composent les molécules. Ce stockage d’énergie au niveau atomique comprend l’énergie associée aux états orbitaux des électrons, au spin nucléaire et aux forces de liaison dans le noyau.
L’enthalpie est représentée par le symbole H , et le changement d’enthalpie dans un processus est H 2 – H 1 .
Il existe des expressions en termes de variables plus familières telles que la température et la pression :
dH = C p dT + V (1-αT) dp
Où C p est la capacité thermique à pression constante et α est le coefficient de dilatation thermique (cubique). Pour un gaz parfait αT = 1 et donc:
dH = C p dT
Exemple: Piston sans friction – Chaleur – Enthalpie
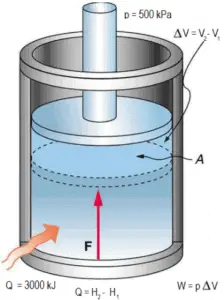
Un piston sans frottement est utilisé pour fournir une pression constante de 500 kPa en une vapeur contenant de cylindre ( vapeur surchauffée ) d’un volume de 2 m 3 à 500 K . Calculez la température finale, si 3000 kJ de chaleur sont ajoutés.
Solution:
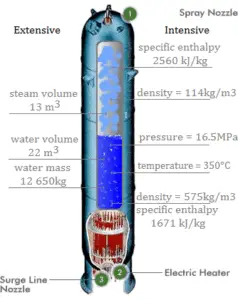
En utilisant des tables à vapeur, nous savons que l’ enthalpie spécifique de cette vapeur (500 kPa; 500 K) est d’environ 2912 kJ / kg . Étant donné qu’à cette condition, la vapeur a une densité de 2,2 kg / m 3 , alors nous savons qu’il y a environ 4,4 kg de vapeur dans le piston à l’enthalpie de 2912 kJ / kg x 4,4 kg = 12812 kJ .
Lorsque nous utilisons simplement Q = H 2 – H 1 , l’enthalpie de vapeur résultante sera alors:
H 2 = H 1 + Q = 15812 kJ
A partir des tables à vapeur , une telle vapeur surchauffée (15812 / 4,4 = 3593 kJ / kg) aura une température de 828 K (555 ° C) . Comme à cette enthalpie, la vapeur a une densité de 1,31 kg / m 3 , il est évident qu’elle a augmenté d’environ 2,2 / 1,31 = 1,67 (+ 67%). Par conséquent, le volume résultant est de 2 m 3 x 1,67 = 3,34 m 3 et ∆V = 3,34 m 3 – 2 m 3 = 1,34 m 3 .
La partie p∆V de l’enthalpie, c’est-à-dire le travail effectué est:
W = p∆V = 500 000 Pa x 1,34 m 3 = 670 kJ
Qu’est-ce que l’entropie
En thermodynamique et en physique statistique, l’ entropie est une mesure quantitative du désordre ou de l’énergie dans un système pour travailler.
En physique statistique, l’entropie est une mesure du désordre d’un système. Ce à quoi se réfère le désordre, c’est vraiment le nombre de configurations microscopiques , W , qu’un système thermodynamique peut avoir lorsqu’il est dans un état tel que spécifié par certaines variables macroscopiques ( volume , énergie , pression et température ). Par «états microscopiques», nous entendons les états exacts de toutes les molécules composant le système.
Mathématiquement, la définition exacte est:
Entropie = (constante de Boltzmann k) x logarithme du nombre d’états possibles
S = k B logW
Cette équation, qui relie les détails microscopiques, ou microstats, du système (via W ) à son état macroscopique (via l’ entropie S ), est l’idée clé de la mécanique statistique. Dans un système fermé, l’entropie ne diminue jamais, donc dans l’Univers l’entropie augmente irréversiblement. Dans un système ouvert (par exemple, un arbre en croissance), l’entropie peut diminuer et l’ordre peut augmenter, mais seulement au détriment d’une augmentation de l’entropie ailleurs (par exemple au Soleil).
Unités d’entropie
L’IS unité pour l’ entropie est J / K . Selon Clausius, l’entropie a été définie via le changement d’entropie S d’un système. L’évolution de l’entropie S, lorsqu’une quantité de chaleur Q lui est ajoutée par un processus réversible à température constante, est donnée par:
Ici Q est l’ énergie transférée sous forme de chaleur vers ou depuis le système pendant le processus, et T est la température du système en kelvins pendant le processus. Si nous supposons un processus isotherme réversible , le changement d’entropie total est donné par:
∆S = S 2 – S 1 = Q / T
Dans cette équation, le quotient Q / T est lié à l’augmentation du désordre. Une température plus élevée signifie un plus grand caractère aléatoire du mouvement. À des températures plus basses, l’ajout de chaleur Q provoque une augmentation fractionnelle substantielle du mouvement moléculaire et de l’aléatoire. En revanche, si la substance est déjà chaude, la même quantité de chaleur Q ajoute relativement peu au plus grand mouvement moléculaire.
Exemple
Calculez le changement d’entropie de 1 kg de glace à 0 ° C, lorsqu’elle est fondue de manière réversible dans de l’eau à 0 ° C.
Puisqu’il s’agit d’un processus isotherme, nous pouvons utiliser:
∆S = S 2 – S 1 = Q / T
par conséquent, le changement d’entropie sera:
∆S = 334 [kJ] / 273,15 [K] = 1,22 [kJ / K]
où 334 kilojoules de chaleur sont nécessaires pour faire fondre 1 kg de glace (chaleur latente de fusion = 334 kJ / kg) et cette chaleur est transférée au système à 0 ° C (273,15 K).
Diagrammes Ts
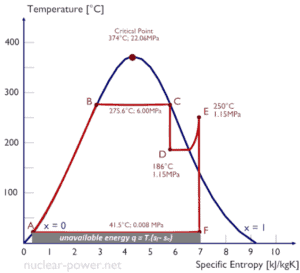
En général, les phases d’une substance et les relations entre ses propriétés sont le plus souvent représentées sur les diagrammes de propriétés . Un grand nombre de propriétés différentes ont été définies et il existe des dépendances entre les propriétés.
Un diagramme température-entropie ( diagramme Ts ) est le type de diagramme le plus fréquemment utilisé pour analyser les cycles du système de transfert d’énergie. Il est utilisé en thermodynamique pour visualiser les changements de température et l’entropie spécifique au cours d’un processus ou cycle thermodynamique.
En effet, le travail effectué par ou sur le système et la chaleur ajoutée ou retirée du système peuvent être visualisés sur le diagramme Ts . Par la définition de l’entropie, la chaleur transférée vers ou depuis un système est égale à l’ aire sous la courbe Ts du processus.
dQ = TdS
Un processus isentropique est représenté comme une ligne verticale sur un diagramme Ts, tandis qu’un processus isotherme est une ligne horizontale. Dans un état idéalisé, la compression est une pompe, la compression dans un compresseur et l’expansion dans une turbine sont des processus isentropiques. Par conséquent, il est très utile en génie électrique, car ces appareils sont utilisés dans les cycles thermodynamiques des centrales électriques.
Notez que les hypothèses isentropiques ne sont applicables qu’avec des cycles idéaux. Les cycles thermodynamiques réels ont des pertes d’énergie inhérentes dues à l’inefficacité des compresseurs et des turbines.
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci