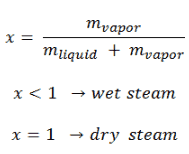Usos del agua en ingeniería nuclear
El agua como refrigerante del reactor
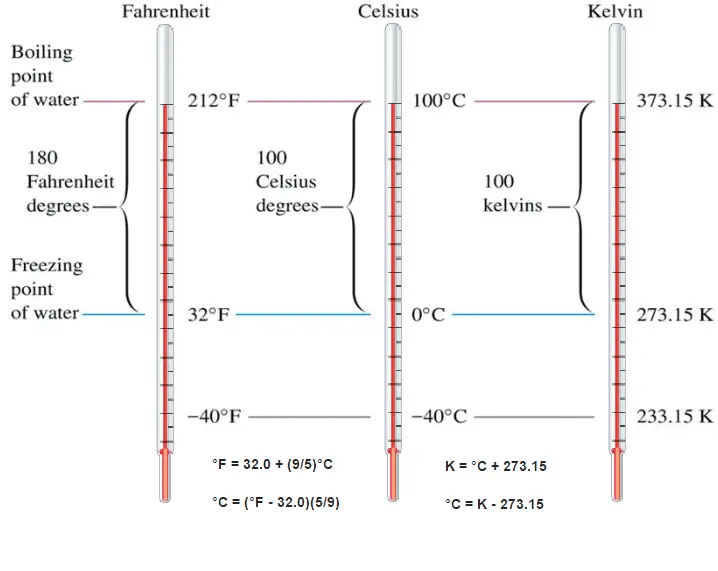
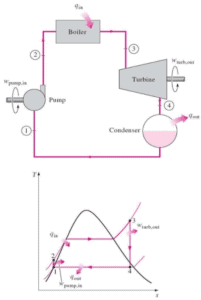
El agua y el vapor son un fluido común utilizado para el intercambio de calor en el circuito primario (desde la superficie de las barras de combustible hasta el flujo de refrigerante) y en el circuito secundario. Se utiliza debido a su disponibilidad y alta capacidad térmica, tanto para enfriamiento como para calefacción. Es especialmente efectivo para transportar calor a través de la vaporización y la condensación del agua debido a su gran calor latente de vaporización .
Una desventaja es que los reactores moderados por agua tienen que usar un circuito primario de alta presión para mantener el agua en estado líquido y para lograr una eficiencia termodinámica suficiente. El agua y el vapor también reaccionan con metales que se encuentran comúnmente en industrias como el acero y el cobre, que se oxidan más rápido por el agua y el vapor no tratados. En casi todas las centrales térmicas (carbón, gas, nuclear), el agua se usa como fluido de trabajo (usado en un circuito cerrado entre la caldera, la turbina de vapor y el condensador), y el refrigerante (usado para intercambiar el calor residual a un cuerpo de agua). o llévelo por evaporación en una torre de enfriamiento).
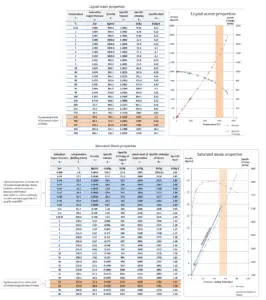
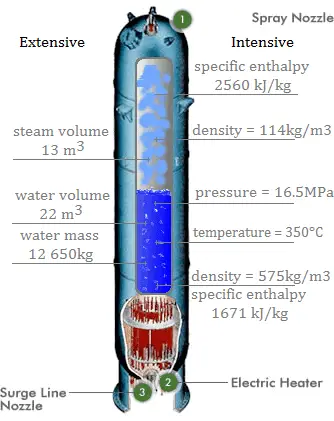
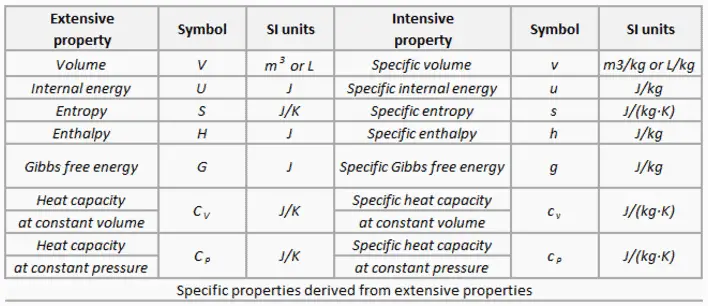
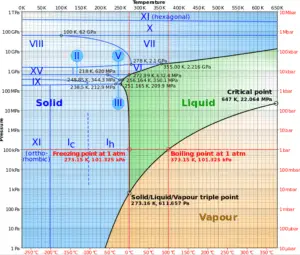
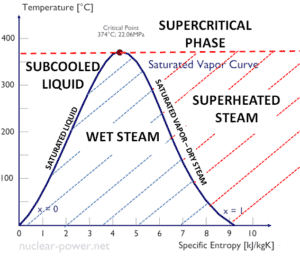
El agua y el vapor son un medio común porque sus propiedades son muy conocidas . Sus propiedades están tabuladas en las llamadas ” Tablas de Steam “. En estas tablas, las propiedades básicas y clave, como la presión, la temperatura, la entalpía, la densidad y el calor específico, se tabulan a lo largo de la curva de saturación vapor-líquido en función de la temperatura y la presión. Las propiedades también están tabuladas para estados monofásicos ( agua comprimida o vapor sobrecalentado ) en una red de temperaturas y presiones que se extienden a 2000 ºC y 1000 MPa.
Se pueden encontrar más datos completos y autorizados en la página del NIST Webbook sobre las propiedades termofísicas de los fluidos.
Ver también: Tablas de vapor
El agua como moderador
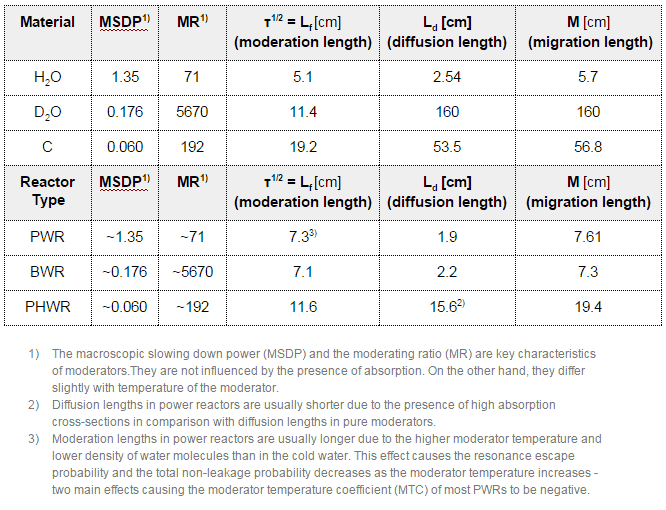
El moderador de neutrones , que es importante en los reactores térmicos , se utiliza para moderar, es decir, ralentizar los neutrones de la fisión a las energías térmicas . Los núcleos con bajos números de masa son más efectivos para este propósito, por lo que el moderador siempre es un material de bajo número de masa. Los moderadores de uso común incluyen agua regular (ligera) (aproximadamente el 75% de los reactores del mundo), grafito sólido (20% de los reactores) y agua pesada (5% de los reactores).
En la mayoría de los reactores nucleares , el agua es tanto un refrigerante como un moderador . La moderación ocurre especialmente en los núcleos de hidrógeno. En el caso del hidrógeno (A = 1) como núcleo objetivo, el neutrón incidente puede detenerse por completo: tiene la disminución de energía logarítmica promedio más alta de todos los núcleos. Por otro lado, los núcleos de hidrógeno tienen una sección transversal de absorción relativamente más alta , por lo tanto, el agua no es el mejor moderador según la relación de moderación .
El agua como blindaje de neutrones
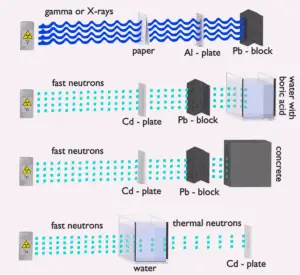
El agua debido al alto contenido de hidrógeno y la disponibilidad es efectiva y la protección común de neutrones . Sin embargo, debido al bajo número atómico de hidrógeno y oxígeno, el agua no es un escudo aceptable contra los rayos gamma. Por otro lado, en algunos casos, esta desventaja (baja densidad) puede compensarse con un alto espesor del escudo de agua. En el caso de los neutrones, el agua modera perfectamente los neutrones, pero con la absorción de neutrones por el núcleo de hidrógeno se producen rayos gamma secundarios con alta energía. Estos rayos gamma penetran altamente en la materia y, por lo tanto, pueden aumentar los requisitos sobre el grosor del escudo de agua. Agregar un ácido bórico puede ayudar con este problema (absorción de neutrones en los núcleos de boro sin una fuerte emisión de rayos gamma), pero resulta en otros problemas con la corrosión de los materiales de construcción.
Ver también: Blindaje de neutrones.
El agua como un escudo de radiación gamma
En resumen, el blindaje efectivo de la radiación gamma se basa en la mayoría de los casos en el uso de materiales con las siguientes dos propiedades:
- Alta densidad de material.
- alto número atómico de material (materiales con alto contenido de Z)
Aunque el agua no es material de alta densidad ni de alta Z , se usa comúnmente como escudos gamma. El agua proporciona una protección contra la radiación de los conjuntos de combustible en una piscina de combustible gastado durante el almacenamiento o durante el transporte desde y hacia el núcleo del reactor . Aunque el agua es un material de baja densidad y un material de baja Z, se usa comúnmente en centrales nucleares, porque estas desventajas pueden compensarse con un mayor espesor.
Capa de agua de valor medio
La capa de valor medio expresa el espesor del material absorbente necesario para la reducción de la intensidad de radiación incidente en un factor de dos .
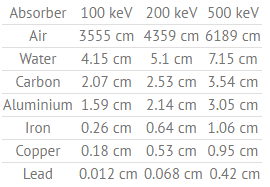
Tabla de capas de valor medio (en cm) para diferentes materiales con energías de rayos gamma de 100, 200 y 500 keV.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.