Ejemplos
Sublimación
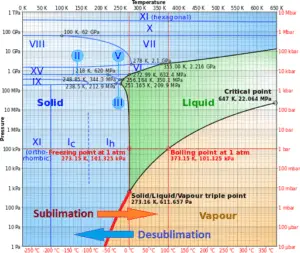
En general, la sublimación es un cambio de fase de una sustancia directamente desde la fase sólida a la fase gaseosa sin pasar por la fase líquida intermedia. La sublimación es un cambio de fase endotérmico que ocurre a temperaturas y presiones por debajo del punto triple de una sustancia en su diagrama de fase.
Considere el hielo a -10 ° C y a la presión de 500 Pa. En este caso, la transferencia de calor al hielo primero resulta en un aumento de la temperatura a -8 ° C. En este punto, sin embargo, el hielo pasa directamente de la fase sólida a la fase de vapor en el proceso conocido como sublimación. El calor correspondiente se llama calor de sublimación , L s . Una mayor transferencia de calor daría como resultado el sobrecalentamiento del vapor.
Dado que la sublimación es un cambio de fase endotérmica, requiere energía adicional. Esta energía adicional requerida puede calcularse agregando la entalpía de fusión y la entalpía de vaporización y se conoce como la entalpía de sublimación (también llamada calor de sublimación).
Para algunas sustancias, la sublimación es mucho más fácil que la evaporación de la masa fundida. Depende de su punto triple. Cuando la presión de su punto triple es demasiado alta, es difícil obtenerlos como líquidos.
El proceso inverso de sublimación es la desublimación, en la que una sustancia pasa directamente de un gas a una fase sólida.
Desublimation

En general, la desublimación (o deposición ) es una transición de fase de una sustancia directamente desde la fase gaseosa a la fase sólida sin pasar a través de la fase líquida intermedia. La desublimación es un cambio de fase exotérmico que ocurre a temperaturas y presiones por debajo del punto triple de una sustancia en su diagrama de fase.
Considere el vapor de agua a -5 ° C y a la presión de 500 Pa. En este caso, cuando se toma calor del vapor de agua, el vapor produce una disminución de la temperatura a -8 ° C. En este punto, sin embargo, el vapor pasa directamente de la fase gaseosa a la fase sólida en el proceso conocido como desublimación. El calor correspondiente se llama calor de sublimación , L s .
Dado que la desublimación es un cambio de fase exotérmico, libera energía. Esta energía liberada se puede calcular agregando la entalpía de fusión y la entalpía de vaporización y se conoce como la entalpía de sublimación (también llamada calor de sublimación).
Para algunas sustancias, la desublimación es mucho más fácil que pasar por la fase líquida. Depende de su punto triple. Cuando la presión de su punto triple es demasiado alta, es difícil obtenerlos como líquidos.
El proceso inverso de la desublimación es la sublimación, en la que una sustancia pasa directamente de una fase sólida a una fase gaseosa.
Un ejemplo de desublimación es cuando se forma escarcha en una hoja en invierno. Para que ocurra la desublimación, la energía térmica debe eliminarse de un gas. Por lo tanto, cuando la hoja se enfría lo suficiente, el vapor de agua en el aire que rodea la hoja puede perder suficiente energía térmica para convertirse directamente en un sólido.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.