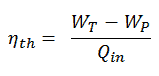Ejemplo de ciclo de Rankine: problema con la solución
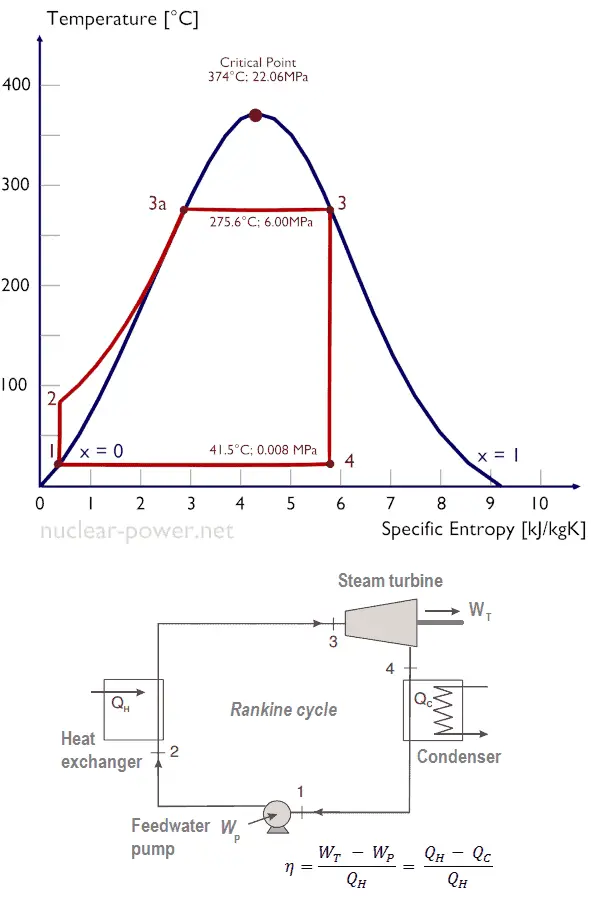 Supongamos el ciclo de Rankine , que es uno de los ciclos termodinámicos más comunes en las centrales térmicas. En este caso, suponga un ciclo simple sin recalentamiento y sin turbina de vapor de condensación funcionando con vapor saturado (vapor seco). En este caso, la turbina opera en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto 3). El vapor sale de esta etapa de la turbina a una presión de 0.008 MPa, 41.5 ° C yx = ??? (punto 4).
Supongamos el ciclo de Rankine , que es uno de los ciclos termodinámicos más comunes en las centrales térmicas. En este caso, suponga un ciclo simple sin recalentamiento y sin turbina de vapor de condensación funcionando con vapor saturado (vapor seco). En este caso, la turbina opera en estado estable con condiciones de entrada de 6 MPa, t = 275.6 ° C, x = 1 (punto 3). El vapor sale de esta etapa de la turbina a una presión de 0.008 MPa, 41.5 ° C yx = ??? (punto 4).
Calcular:
- la calidad del vapor del vapor de salida
- la diferencia de entalpía entre estos dos estados (3 → 4), que corresponde al trabajo realizado por el vapor, W T .
- la diferencia de entalpía entre estos dos estados (1 → 2), que corresponde a la labor realizada por las bombas, W P .
- La diferencia de entalpía entre estos dos estados (2 → 3), que corresponde al calor neto agregado en el generador de vapor
- la eficiencia termodinámica de este ciclo y compare este valor con la eficiencia de Carnot
1)
Como no conocemos la calidad exacta del vapor del vapor de salida, tenemos que determinar este parámetro. El estado 4 está fijado por la presión p 4 = 0.008 MPa y el hecho de que la entropía específica es constante para la expansión isentrópica (s 3 = s 4 = 5.89 kJ / kgK para 6 MPa ). La entropía específica del agua líquida saturada (x = 0) y el vapor seco (x = 1) puede seleccionarse de las tablas de vapor . En caso de vapor húmedo, la entropía real se puede calcular con la calidad del vapor, x, y las entropías específicas de agua líquida saturada y vapor seco:
s 4 = s v x + (1 – x) s l
dónde
s 4 = entropía de vapor húmedo (J / kg K) = 5.89 kJ / kgK
s v = entropía de vapor “seco” (J / kg K) = 8.227 kJ / kgK (para 0.008 MPa)
s l = entropía de agua líquida saturada (J / kg K) = 0.592 kJ / kgK (para 0.008 MPa)
De esta ecuación, la calidad del vapor es:
x 4 = ( s 4 – s l ) / ( s v – s l ) = (5.89 – 0.592) / (8.227 – 0.592) = 0.694 = 69.4%
2)
La entalpía para el estado 3 puede seleccionarse directamente de las mesas de vapor, mientras que la entalpía para el estado 4 debe calcularse utilizando la calidad del vapor:
h 3, v = 2785 kJ / kg
h 4, húmedo = h 4, v x + (1 – x) h 4, l = 2576. 0.694 + (1 – 0.694). 174 = 1787 + 53,2 = 1840 kJ / kg
Entonces el trabajo realizado por el vapor, W T, es
W T = Δh = 945 kJ / kg
3)
La entalpía para el estado 1 puede seleccionarse directamente de las mesas de vapor:
h 1, l = 174 kJ / kg
El estado 2 está fijado por la presión p 2 = 6.0 MPa y el hecho de que la entropía específica es constante para la compresión isentrópica (s 1 = s 2 = 0.592 kJ / kgK para 0.008 MPa ). Para esta entropía s 2 = 0.592 kJ / kgK y p 2 = 6.0 MPa encontramos h 2, subenfriado en tablas de vapor para agua comprimida (usando interpolación entre dos estados).
h 2, subenfriado = 179.7 kJ / kg
Entonces el trabajo realizado por las bombas, W P, es
W P = Δh = 5.7 kJ / kg
4)
La diferencia de entalpía entre (2 → 3), que corresponde al calor neto agregado en el generador de vapor, es simplemente:
Q add = h 3, v – h 2, subenfriado = 2785 – 179.7 = 2605.3 kJ / kg
Tenga en cuenta que no hay regeneración de calor en este ciclo. Por otro lado, la mayor parte del calor agregado es para la entalpía de vaporización (es decir, para el cambio de fase).
5)
En este caso, los generadores de vapor, la turbina de vapor, los condensadores y las bombas de agua de alimentación constituyen un motor térmico, sujeto a las limitaciones de eficiencia impuestas por la segunda ley de la termodinámica . En el caso ideal (sin fricción, procesos reversibles, diseño perfecto), este motor térmico tendría una eficiencia de Carnot de
η Carnot = 1 – T frío / T caliente = 1 – 315/549 = 42.6%
donde la temperatura del depósito caliente es de 275.6 ° C (548.7 K), la temperatura del depósito frío es de 41.5 ° C (314.7K).
La eficiencia termodinámica de este ciclo se puede calcular mediante la siguiente fórmula:
así
η th = (945 – 5.7) / 2605.3 = 0.361 = 36.1%
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.