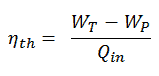Exemplo de ciclo Rankine – problema com solução
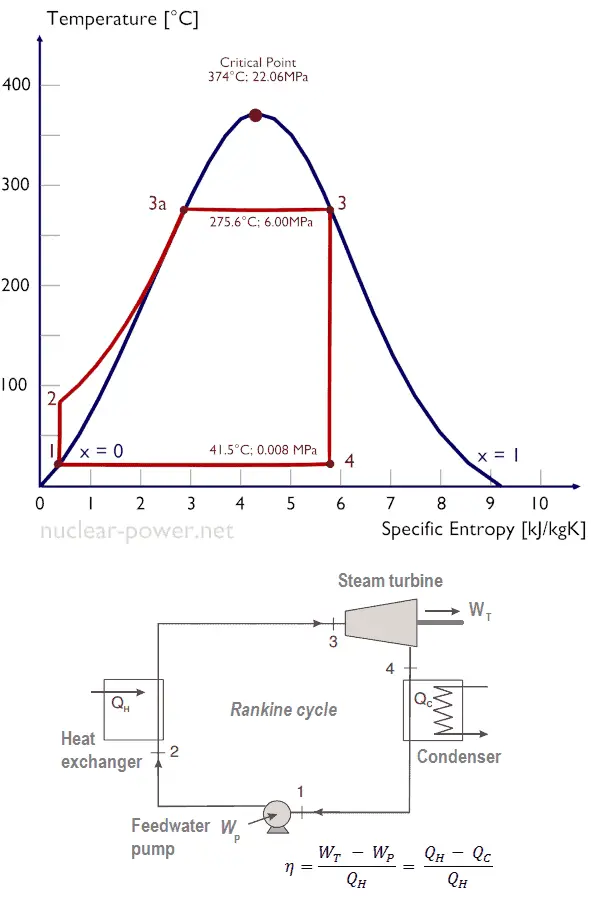 Vamos assumir o ciclo Rankine , que é um dos ciclos termodinâmicos mais comuns em usinas termelétricas. Nesse caso, assuma um ciclo simples, sem reaquecimento e sem a turbina a vapor de condensação funcionando com vapor saturado (vapor seco). Nesse caso, a turbina opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto 3). O vapor sai deste estágio da turbina a uma pressão de 0,008 MPa, 41,5 ° C e x = ??? (ponto 4)
Vamos assumir o ciclo Rankine , que é um dos ciclos termodinâmicos mais comuns em usinas termelétricas. Nesse caso, assuma um ciclo simples, sem reaquecimento e sem a turbina a vapor de condensação funcionando com vapor saturado (vapor seco). Nesse caso, a turbina opera em estado estacionário com condições de entrada de 6 MPa, t = 275,6 ° C, x = 1 (ponto 3). O vapor sai deste estágio da turbina a uma pressão de 0,008 MPa, 41,5 ° C e x = ??? (ponto 4)
Calcular:
- a qualidade do vapor do vapor de saída
- a diferença de entalpia entre estes dois estados (3 → 4), a qual corresponde ao trabalho realizado pelo vapor, W t .
- a diferença de entalpia entre estes dois estados (1 → 2), que corresponde ao trabalho feito por bombas, W P .
- a diferença de entalpia entre esses dois estados (2 → 3), que corresponde ao calor líquido adicionado no gerador de vapor
- a eficiência termodinâmica deste ciclo e compare esse valor com a eficiência de Carnot
1)
Como não sabemos a qualidade exata do vapor de saída, precisamos determinar esse parâmetro. O estado 4 é fixado pela pressão p 4 = 0,008 MPa e o fato de que a entropia específica é constante para a expansão isentrópica (s 3 = s 4 = 5,89 kJ / kgK para 6 MPa ). A entropia específica de água líquida saturada (x = 0) e vapor seco (x = 1) pode ser escolhida nas tabelas de vapor . No caso de vapor úmido, a entropia real pode ser calculada com a qualidade do vapor, x, e as entropias específicas de água líquida saturada e vapor seco:
s 4 = s v x + (1 – x) s l
Onde
s 4 = entropia de vapor úmido (J / kg K) = 5,89 kJ / kgK
s v = entropia do vapor “seco” (J / kg K) = 8,227 kJ / kgK (para 0,008 MPa)
s l = entropia de água líquida saturada (J / kg K) = 0,592 kJ / kgK (para 0,008 MPa)
A partir desta equação, a qualidade do vapor é:
x 4 = ( s 4 – s l ) / ( s v – s l ) = (5,89 – 0,592) / (8,227 – 0,592) = 0,694 = 69,4%
2)
A entalpia para o estado 3 pode ser coletada diretamente das tabelas de vapor, enquanto a entalpia para o estado 4 deve ser calculada usando a qualidade do vapor:
h 3, v = 2785 kJ / kg
h 4, molhado = h 4, v x + (1 – x) h 4, l = 2576. 0,694 + (1 – 0,694). 174 = 1787 + 53,2 = 1840 kJ / kg
Então o trabalho realizado pelo vapor, W T, é
W T = Δh = 945 kJ / kg
3)
A entalpia para o estado 1 pode ser obtida diretamente das tabelas de vapor:
h 1, l = 174 kJ / kg
O estado 2 é fixado pela pressão p 2 = 6,0 MPa e pelo fato de a entropia específica ser constante para a compressão isentrópica (s 1 = s 2 = 0,592 kJ / kgK para 0,008 MPa ). Para esta entropia s 2 = 0,592 kJ / kgK ep 2 = 6,0 MPa, encontramos h 2, sub-resfriado em tabelas de vapor para água comprimida (usando interpolação entre dois estados).
h 2, sub-resfriado = 179,7 kJ / kg
Então, o trabalho realizado pelas bombas, W P, é
W P = Δh = 5,7 kJ / kg
4)
A diferença de entalpia entre (2 → 3), que corresponde ao calor líquido adicionado no gerador de vapor, é simplesmente:
Q add = h 3, v – h 2, sub-resfriado = 2785 – 179,7 = 2605,3 kJ / kg
Observe que, não há regeneração de calor neste ciclo. Por outro lado, a maior parte do calor adicionado é para a entalpia da vaporização (isto é, para a mudança de fase).
5)
Nesse caso, geradores de vapor, turbinas a vapor, condensadores e bombas de água de alimentação constituem um motor térmico, sujeito às limitações de eficiência impostas pela segunda lei da termodinâmica . No caso ideal (sem atrito, processos reversíveis, design perfeito), este motor térmico teria uma eficiência de Carnot de
η Carnot = 1 – T frio / T quente = 1 – 315/549 = 42,6%
onde a temperatura do reservatório quente é de 275,6 ° C (548,7 K), a temperatura do reservatório frio é de 41,5 ° C (314,7 K).
A eficiência termodinâmica deste ciclo pode ser calculada pela seguinte fórmula:
assim
η th = (945 – 5,7) / 2605,3 = 0,361 = 36,1%
……………………………………………………………………………………………………………………………….
Este artigo é baseado na tradução automática do artigo original em inglês. Para mais informações, consulte o artigo em inglês. Você pode nos ajudar. Se você deseja corrigir a tradução, envie-a para: translations@nuclear-power.com ou preencha o formulário de tradução on-line. Agradecemos sua ajuda, atualizaremos a tradução o mais rápido possível. Obrigado.