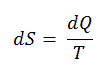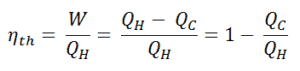Segunda ley de la termodinámica
La entropía de cualquier sistema aislado nunca disminuye. En un proceso termodinámico natural, aumenta la suma de las entropías de los sistemas termodinámicos que interactúan.
 Esta ley indica la irreversibilidad de los procesos naturales . Los procesos reversibles son una ficción teórica útil y conveniente, pero no ocurren en la naturaleza. De esta ley se deduce que es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente. De ello se deduce que las máquinas de movimiento perpetuo del segundo tipo son imposibles.
Esta ley indica la irreversibilidad de los procesos naturales . Los procesos reversibles son una ficción teórica útil y conveniente, pero no ocurren en la naturaleza. De esta ley se deduce que es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente. De ello se deduce que las máquinas de movimiento perpetuo del segundo tipo son imposibles.
La segunda ley de la termodinámica es un principio general, que va más allá de las limitaciones impuestas por la primera ley de la termodinámica . La primera ley se usa para relacionar y evaluar las diversas energías involucradas en un proceso. Sin embargo, no se puede obtener información sobre la dirección del proceso mediante la aplicación de la primera ley. La segunda ley de la termodinámica impone restricciones sobre la dirección de la transferencia de calor y establece un límite superior para la eficiencia de la conversión de calor para trabajar en motores de calor . Entonces, la segunda ley es directamente relevante para muchos problemas prácticos importantes.
Una de las áreas de aplicación de la segunda ley de la termodinámica es el estudio de los sistemas de conversión de energía. Por ejemplo, no es posible convertir toda la energía obtenida de un carbón en una central eléctrica a carbón o de un reactor nuclear en una central nuclear en energía eléctrica. Debe haber pérdidas en el proceso de conversión.
Dirección de Procesos Termodinámicos
Muchos procesos termodinámicos proceden naturalmente en una dirección pero no al contrario. Por ejemplo, cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío , nunca al revés. De hecho, dicho flujo de calor (de un cuerpo más frío a un sistema más cálido) no violaría la primera ley de la termodinámica , es decir, se conservaría la energía. Pero no sucede en la naturaleza.
Por ejemplo, quemar gasolina para impulsar automóviles es un proceso de conversión de energía en el que confiamos. La energía química en la gasolina se convierte en energía térmica , que luego se convierte en energía mecánica que hace que el automóvil se mueva. La energía mecánica se ha convertido en energía cinética . Cuando usamos los frenos para detener un automóvil, esa energía cinética se convierte por fricción en calor o energía térmica . En esta dirección inversa, hay muchos dispositivos que convierten el calor parcialmente en energía mecánica. Pero no se puede construir una máquina que convierta el calor por completo en energía mecánica. Siempre habrá pérdidas significativas de energía.
Las direcciones de los procesos termodinámicos están sujetas a la segunda ley de la termodinámica, especialmente a la Declaración de Clausius de la Segunda Ley .
Diversas declaraciones de la ley
La segunda ley de la termodinámica se puede expresar de muchas maneras específicas. Cada declaración expresa la misma ley. A continuación se enumeran tres que a menudo se encuentran.
- Declaración de Clausius
- Declaración de Kelvin-Planck
- La entropía y la segunda ley
Antes de estas declaraciones, tenemos que recordar el trabajo de un ingeniero y físico francés, Nicolas Léonard Sadi Carnot avanzó el estudio de la segunda ley al formar un principio ( también llamado regla de Carnot ) que especifica los límites de la máxima eficiencia que cualquier motor térmico puede obtener .
Declaración de Clausius de la segunda ley
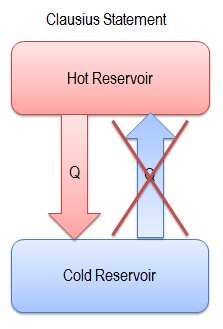 Una de las primeras declaraciones de la Segunda Ley de la Termodinámica fue hecha por R. Clausius en 1850 . Él dijo lo siguiente.
Una de las primeras declaraciones de la Segunda Ley de la Termodinámica fue hecha por R. Clausius en 1850 . Él dijo lo siguiente.
“Es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente”.
El calor no puede fluir espontáneamente del sistema frío al sistema caliente sin realizar un trabajo externo en el sistema. Esto es exactamente lo que logran los refrigeradores y las bombas de calor. En un refrigerador, el calor fluye de frío a caliente, pero solo cuando es forzado por un trabajo externo, los refrigeradores son impulsados por motores eléctricos que requieren trabajo de su entorno para funcionar.
Las declaraciones de Clausius y Kelvin-Planck han demostrado ser equivalentes.
Declaración de Kelvin-Planck de la Segunda Ley
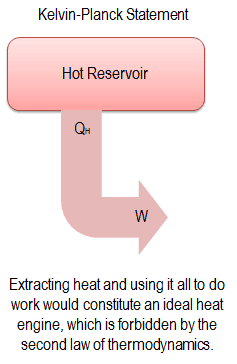 “Es imposible construir un dispositivo que funcione en un ciclo y no produzca otro efecto que la producción de trabajo y la transferencia de calor de un solo cuerpo”.
“Es imposible construir un dispositivo que funcione en un ciclo y no produzca otro efecto que la producción de trabajo y la transferencia de calor de un solo cuerpo”.
Esta declaración opera con el término ” depósito térmico ” o ” depósito único “. Un depósito es un objeto grande, en el que la temperatura permanece constante mientras se extrae la energía. Tal sistema puede ser aproximado de varias maneras: por la atmósfera de la tierra, grandes cuerpos de agua como lagos, océanos, etc.
La declaración de Kelvin-Planck no excluye la existencia de un sistema, que desarrolla una cantidad neta de trabajo de una transferencia de calor extraída de un depósito térmico. Según esta declaración, un sistema que experimenta un ciclo no puede desarrollar una cantidad neta positiva de trabajo de una transferencia de calor extraída de un depósito térmico.
La entropía y la segunda ley
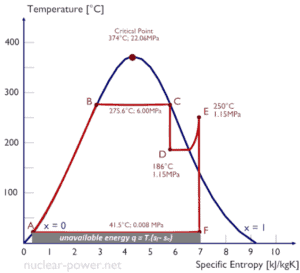
Una consecuencia de la segunda ley de la termodinámica es el desarrollo de la propiedad física de la materia, que se conoce como entropía (S) . El cambio en esta propiedad se utiliza para determinar la dirección en la que procederá un proceso determinado. La entropía cuantifica la energía de una sustancia que ya no está disponible para realizar un trabajo útil . Esto se relaciona con la segunda ley, ya que la segunda ley predice que no todo el calor proporcionado a un ciclo puede transformarse en una cantidad igual de trabajo, debe producirse un cierto rechazo de calor.
Ver también: entropía
Según Clausius, la entropía se definió mediante el cambio en la entropía S de un sistema. El cambio en la entropía S, cuando se le agrega una cantidad de calor Q mediante un proceso reversible a temperatura constante, viene dado por:
Aquí Q es la energía transferida como calor hacia o desde el sistema durante el proceso, y T es la temperatura del sistema en grados Kelvin durante el proceso. La unidad SI de la entropía es J / K .
La segunda ley de la termodinámica también se puede expresar como ∆S≥0 para un ciclo cerrado.
En palabras:
La entropía de cualquier sistema aislado nunca disminuye. En un proceso termodinámico natural, aumenta la suma de las entropías de los sistemas termodinámicos que interactúan.
≥S≥0
Debido a que la entropía dice mucho acerca de la utilidad de una cantidad de calor transferida en la realización del trabajo, las tablas de vapor incluyen valores de entropía específica (s = S / m) como parte de la información tabulada.
Motores de calor
Las fuentes de energía siempre han jugado un papel muy importante en el desarrollo de la sociedad humana. La energía generalmente se define como el potencial para hacer trabajo o producir calor . A veces es como la “moneda” para realizar el trabajo. Una de las propiedades más maravillosas del universo es que la energía puede transformarse de un tipo a otro y transferirse de un objeto a otro .
En general, es fácil producir energía térmica haciendo trabajo , por ejemplo, mediante cualquier proceso de fricción. Pero obtener trabajo de la energía térmica es más difícil . Está estrechamente asociado con el concepto de entropía . Por ejemplo, la electricidad es particularmente útil ya que tiene una entropía muy baja (está altamente ordenada) y puede convertirse en otras formas de energía de manera muy eficiente .
A veces, la energía mecánica está directamente disponible, por ejemplo, la energía eólica y la energía hidroeléctrica. Pero la mayor parte de nuestra energía proviene de la quema de combustibles fósiles (carbón, petróleo y gas) y de reacciones nucleares . En la actualidad, el combustible fósil sigue siendo la fuente de energía predominante del mundo. Pero la quema de combustibles fósiles genera solo energía térmica , por lo tanto, estas fuentes de energía se denominan ” fuentes de energía primaria “, que deben convertirse en fuente de energía secundaria , los llamados portadores de energía ( energía eléctrica, etc.). Para convertir la energía térmica en otra forma de energía, un motor térmico debe ser usado.
En general, un motor térmico es un dispositivo que convierte la energía química en calor o energía térmica y luego en energía mecánica o eléctrica.
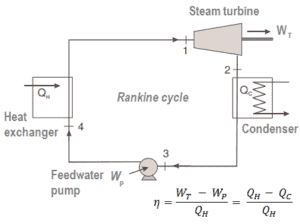
Muchos motores térmicos funcionan de manera cíclica, agregando energía en forma de calor en una parte del ciclo y utilizando esa energía para realizar un trabajo útil en otra parte del ciclo.
Por ejemplo, como es típico en todas las centrales térmicas convencionales , el calor se utiliza para generar vapor que impulsa una turbina de vapor conectada a un generador que produce electricidad. Los generadores de vapor, las turbinas de vapor, los condensadores y las bombas de agua de alimentación constituyen un motor térmico , sujeto a las limitaciones de eficiencia impuestas por la segunda ley de la termodinámica . En las centrales nucleares modernas, la eficiencia termodinámica general es aproximadamenteun tercio (33%), por lo que se necesitan 3000 MWth de energía térmica de la reacción de fisión para generar 1000 MWe de energía eléctrica.
Tipos de motores de calor
En general, los motores térmicos se clasifican según una ubicación de combustión como:
- Motor de combustión externa. Por ejemplo, las máquinas de vapor son motores de combustión externa, donde el fluido de trabajo está separado de los productos de combustión.
- Motor de combustión interna. Un ejemplo típico de motor de combustión interna es un motor usado en un automóvil, en el cual la alta temperatura se logra al quemar la mezcla de gasolina y aire en el cilindro mismo.
La categorización detallada se basa en un fluido de trabajo utilizado en el ciclo termodinámico:
- Ciclos de gas. En estos ciclos, el fluido de trabajo es siempre un gas. El ciclo Otto y el ciclo Diesel (usado en automóviles) también son ejemplos típicos de ciclos de solo gas. Los modernos motores de turbina de gas y los motores de inyección de aire también basados en el ciclo de solo gas, siguen el ciclo de Brayton.
- Ciclos de líquidos. Los ciclos de solo líquido son bastante exóticos. En estos ciclos, el fluido de trabajo es siempre un líquido. El motor líquido Malone es un ejemplo de ciclo de solo líquido. El motor líquido Malone fue una modificación del ciclo de Stirling, utilizando agua como fluido de trabajo en lugar de gas.
- Ciclos con cambios de fase. Los motores de vapor son ejemplos típicos de motores externos con cambio de fase del fluido de trabajo.
Ejemplo de motor térmico
Los motores de vapor y los refrigeradores son ejemplos típicos de motores externos con cambio de fase de fluido de trabajo. El ciclo termodinámico típico utilizado para analizar este proceso se llama ciclo de Rankine , que generalmente usa agua como fluido de trabajo.
El ciclo de Rankine describe de cerca los procesos en motores de calor operados por vapor que se encuentran comúnmente en la mayoría de las centrales térmicas . Las fuentes de calor utilizadas en estas centrales eléctricas suelen ser la combustión de combustibles fósiles como el carbón, el gas natural o también la fisión nuclear .
Una planta de energía nuclear (estación de energía nuclear) se parece a una estación de energía térmica estándar con una excepción. La fuente de calor en la central nuclear es un reactor nuclear . Como es típico en todas las centrales térmicas convencionales, el calor se utiliza para generar vapor que impulsa una turbina de vapor conectada a un generador que produce electricidad.
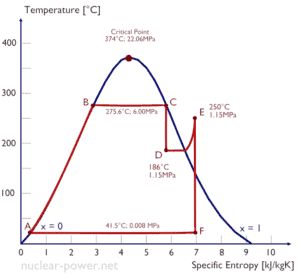
Típicamente, la mayoría de las plantas de energía nuclear opera turbinas de vapor de condensación de etapas múltiples . En estas turbinas, la etapa de alta presión recibe vapor (este vapor es vapor casi saturado – x = 0.995 – punto C en la figura; 6 MPa ; 275.6 ° C) desde un generador de vapor y lo expulsa al separador-recalentador de humedad (punto D ) El vapor debe recalentarse para evitar daños que puedan ocasionar a las aspas de la turbina de vapor el vapor de baja calidad . El recalentador calienta el vapor (punto D) y luego el vapor se dirige a la etapa de baja presión de la turbina de vapor, donde se expande (punto E a F). El vapor agotado se condensa en el condensador y está a una presión muy por debajo de la atmosférica (presión absoluta de0.008 MPa ), y está en un estado parcialmente condensado (punto F), típicamente de una calidad cercana al 90%.
En este caso, los generadores de vapor, la turbina de vapor, los condensadores y las bombas de agua de alimentación constituyen un motor térmico, sujeto a las limitaciones de eficiencia impuestas por la segunda ley de la termodinámica . En el caso ideal (sin fricción, procesos reversibles, diseño perfecto), este motor térmico tendría una eficiencia de Carnot de
= 1 – T frío / T caliente = 1 – 315/549 = 42.6%
donde la temperatura del depósito caliente es 275.6 ° C (548.7K), la temperatura del depósito frío es 41.5 ° C (314.7K). Pero la central nuclear es el motor térmico real , en el que los procesos termodinámicos son de alguna manera irreversibles. No se hacen infinitamente lento. En dispositivos reales (como turbinas, bombas y compresores) una fricción mecánica y pérdidas de calor causan pérdidas adicionales de eficiencia.
Por lo tanto, las centrales nucleares suelen tener una eficiencia de aproximadamente el 33%. En las centrales nucleares modernas, la eficiencia termodinámica general es de aproximadamente un tercio (33%), por lo que se necesitan 3000 MWth de energía térmica de la reacción de fisión para generar 1000 MWe de energía eléctrica.
De acuerdo con el principio de Carnot, se pueden lograr mayores eficiencias aumentando la temperatura del vapor. Pero esto requiere un aumento de las presiones dentro de las calderas o generadores de vapor. Sin embargo, las consideraciones metalúrgicas ponen límites superiores a tales presiones. Desde este punto de vista, los reactores de agua supercríticos se consideran un avance prometedor para las centrales nucleares debido a su alta eficiencia térmica (~ 45% frente a ~ 33% para los LWR actuales). Los SCWR funcionan a presión supercrítica (es decir, superior a 22,1 MPa).
Eficiencia térmica y la segunda ley
Un motor térmico ideal es un motor imaginario en el que la energía extraída como calor del depósito de alta temperatura se convierte por completo en trabajo. Pero de acuerdo con la declaración de Kelvin-Planck , tal motor violaría la segunda ley de la termodinámica, porque debe haber pérdidas en el proceso de conversión. El calor neto agregado al sistema debe ser mayor que el trabajo neto realizado por el sistema.
Declaración de Kelvin-Planck:
“Es imposible construir un dispositivo que funcione en un ciclo y no produzca otro efecto que la producción de trabajo y la transferencia de calor de un solo cuerpo”.
Fórmula de eficiencia térmica
Como resultado de esta declaración, se define el rendimiento térmico , η º , de cualquier motor térmico como la relación entre el trabajo que hace, W , para el calor de entrada a la alta temperatura, Q H .
La eficiencia térmica , η th , representa la fracción de calor , Q H , que se convierte en trabajo . Es una medida de rendimiento sin dimensiones de un motor térmico que utiliza energía térmica, como una turbina de vapor, un motor de combustión interna o un refrigerador. Para una bomba de refrigeración o de calor, la eficiencia térmica indica el grado en que la energía agregada por el trabajo se convierte en salida neta de calor. Como es un número adimensional, siempre debemos expresar W, Q H y Q C en las mismas unidades.
Dado que la energía se conserva de acuerdo con la primera ley de la termodinámica y la energía no se puede convertir en trabajo por completo, la entrada de calor, Q H , debe ser igual al trabajo realizado, W, más el calor que se debe disipar como calor residual Q C en el ambiente. Por lo tanto, podemos reescribir la fórmula para la eficiencia térmica como:
Para dar la eficiencia como un porcentaje, multiplicamos la fórmula anterior por 100. Tenga en cuenta que, η th podría ser 100% solo si el calor residual Q C será cero.
En general, la eficiencia de incluso los mejores motores térmicos es bastante baja. En resumen, es muy difícil de convertir la energía térmica a la energía mecánica . Las eficiencias térmicas suelen ser inferiores al 50% y, a menudo, muy inferiores. Tenga cuidado cuando lo compara con la eficiencia de la energía eólica o hidroeléctrica (las turbinas eólicas no son motores de calor), no hay conversión de energía entre la energía térmica y mecánica.
Causas de ineficiencia
Como se discutió, una eficiencia puede variar entre 0 y 1. Cada motor térmico es de alguna manera ineficiente. Esta ineficiencia puede atribuirse a tres causas.
- Irreversibilidad de los procesos . Existe un límite superior teórico general para la eficiencia de la conversión de calor para trabajar en cualquier motor térmico. Este límite superior se llama eficiencia de Carnot . Según el principio de Carnot , ningún motor puede ser más eficiente que un motor reversible ( un motor térmico de Carnot ) que opera entre los mismos depósitos de alta temperatura y baja temperatura. Por ejemplo, cuando el depósito caliente tiene T caliente de 400 ° C (673K) y T frío de aproximadamente 20 ° C (293K), la eficiencia máxima (ideal) será: = 1 – T frío / T caliente = 1 – 293 / 673 = 56%. Pero todos los procesos termodinámicos reales son de alguna manera irreversibles.. No se hacen infinitamente lento. Por lo tanto, los motores térmicos deben tener eficiencias más bajas que los límites en su eficiencia debido a la irreversibilidad inherente del ciclo del motor térmico que usan.
- Presencia de fricción y pérdidas de calor. En sistemas termodinámicos reales o en motores de calor real, una parte de la ineficiencia general del ciclo se debe a las pérdidas de los componentes individuales. En dispositivos reales (como turbinas, bombas y compresores), una fricción mecánica , pérdidas de calor y pérdidas en el proceso de combustión causan pérdidas adicionales de eficiencia.
- Ineficiencia de diseño . Finalmente, la última y también importante fuente de ineficiencias son los compromisos asumidos por los ingenieros al diseñar un motor térmico (por ejemplo, una central eléctrica). Deben considerar el costo y otros factores en el diseño y operación del ciclo. Como ejemplo, considere un diseño del condensador en las centrales térmicas. Idealmente, el vapor extraído al condensador no tendría subenfriamiento . Pero los condensadores reales están diseñados para subenfriar el líquido unos pocos grados centígrados para evitar la cavitación por succión en las bombas de condensado. Pero, este subenfriamiento aumenta la ineficiencia del ciclo, porque se necesita más energía para recalentar el agua.
Eficiencia Térmica de Motores de Calor
En general, la eficiencia de incluso los mejores motores térmicos es bastante baja. En resumen, es muy difícil convertir la energía térmica en energía mecánica . Las eficiencias térmicas suelen ser inferiores al 50% y, a menudo, muy inferiores.
Es fácil producir energía térmica haciendo trabajo, por ejemplo, mediante cualquier proceso de fricción. Pero obtener trabajo de la energía térmica es más difícil. Está estrechamente asociado con el concepto de entropía , que cuantifica la energía de una sustancia que ya no está disponible para realizar un trabajo útil. Por ejemplo, la electricidad es particularmente útil ya que tiene una entropía muy baja (está altamente ordenada) y puede convertirse en otras formas de energía de manera muy eficiente . Tenga cuidado cuando lo compara con la eficiencia de la energía eólica o hidroeléctrica (las turbinas eólicas no son motores de calor), no hay conversión de energía entre la energía térmica y mecánica.
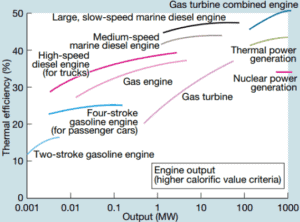
La eficiencia térmica de varios motores térmicos diseñados o utilizados hoy en día tiene una amplia gama:
Por ejemplo:
Transporte
- A mediados del siglo XX, una locomotora de vapor típica tenía una eficiencia térmica de aproximadamente el 6% . Eso significa que por cada 100 MJ de carbón quemado, se produjeron 6 MJ de potencia mecánica.
- Un motor automotriz de gasolina típico opera alrededor del 25% al 30% de la eficiencia térmica. Aproximadamente 70-75% se rechaza como calor residual sin convertirse en trabajo útil, es decir, trabajo entregado a las ruedas.
- Un motor automotriz diesel típico opera alrededor del 30% al 35% . En general, los motores que utilizan el ciclo Diesel suelen ser más eficientes.
- En 2014, se introdujeron nuevas regulaciones para los autos de Fórmula 1 . Estas regulaciones de automovilismo han empujado a los equipos a desarrollar unidades de potencia altamente eficientes. Según Mercedes, su unidad de potencia ahora está logrando más del 45% y cerca del 50% de eficiencia térmica, es decir, el 45 – 50% de la energía potencial en el combustible se entrega a las ruedas.
- El motor diesel tiene la mayor eficiencia térmica de cualquier motor de combustión práctico. Los motores diesel de baja velocidad (como se usan en los barcos) pueden tener una eficiencia térmica que excede el 50% . El motor diésel más grande del mundo alcanza el 51,7%.
Ingeniería de la Energía
- Conversión de energía térmica oceánica (OTEC). OTEC es un motor térmico muy sofisticado que utiliza la diferencia de temperatura entre las aguas marinas superficiales más frías y más cálidas para hacer funcionar una turbina de baja presión. Dado que la diferencia de temperatura es baja , aproximadamente 20 ° C, su eficiencia térmica también es muy baja, aproximadamente 3% .
- En las centrales nucleares modernas, la eficiencia térmica general es de aproximadamente un tercio (33%), por lo que se necesitan 3000 MWth de energía térmica de la reacción de fisión para generar 1000 MWe de energía eléctrica. Se pueden lograr mayores eficiencias aumentando la temperatura del vapor . Pero esto requiere un aumento de las presiones dentro de las calderas o generadores de vapor.. Sin embargo, las consideraciones metalúrgicas ponen límites superiores a tales presiones. En comparación con otras fuentes de energía, la eficiencia térmica del 33% no es mucho. Pero debe tenerse en cuenta que las centrales nucleares son mucho más complejas que las centrales de combustibles fósiles y es mucho más fácil quemar combustibles fósiles que generar energía a partir de combustibles nucleares .
- Las plantas de energía de combustible fósil subcrítico, que funcionan bajo presión crítica (es decir, por debajo de 22.1 MPa), pueden lograr una eficiencia de 36 a 40%.
- Los reactores de agua supercríticos se consideran un avance prometedor para las centrales nucleares debido a su alta eficiencia térmica (~ 45% frente a ~ 33% para los actuales LWR).
- Las plantas de energía de combustible fósil supercrítico, que funcionan a presión supercrítica (es decir, superior a 22,1 MPa), tienen una eficiencia de alrededor del 43% . Las centrales eléctricas de carbón más eficientes y también muy complejas que funcionan a presiones “ultra críticas” (es decir, alrededor de 30 MPa) y usan recalentamiento de etapas múltiples alcanzan aproximadamente el 48% de eficiencia.
- Las plantas modernas de turbina de gas de ciclo combinado (CCGT), en las que el ciclo termodinámico consta de dos ciclos de planta de energía (por ejemplo, el ciclo Brayton y el ciclo Rankine), pueden lograr una eficiencia térmica de alrededor del 55% , en contraste con un ciclo de vapor único planta de energía que se limita a eficiencias de alrededor del 35-45%.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.