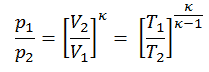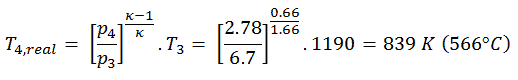Proceso adiabático
Un proceso adiabático es un proceso termodinámico , en el que no hay transferencia de calor dentro o fuera del sistema (Q = 0). El sistema puede considerarse perfectamente aislado . En un proceso adiabático, la energía se transfiere solo como trabajo. La suposición de que no hay transferencia de calor es muy importante, ya que podemos usar la aproximación adiabática solo en procesos muy rápidos . En estos procesos rápidos, no hay tiempo suficiente para que la transferencia de energía como calor tenga lugar hacia o desde el sistema.
En dispositivos reales (como turbinas, bombas y compresores) se producen pérdidas de calor y pérdidas en el proceso de combustión, pero estas pérdidas suelen ser bajas en comparación con el flujo de energía general y podemos aproximar algunos procesos termodinámicos por el proceso adiabático.
Proceso adiabático y la primera ley
Para un sistema cerrado, podemos escribir la primera ley de la termodinámica en términos de entalpía :
dH = dQ + Vdp
En esta ecuación, el término Vdp es un proceso de flujo de trabajo . Este trabajo, Vdp, se utiliza para sistemas de flujo abierto como una turbina o una bomba en la que hay un “dp”, es decir, un cambio de presión. Como puede verse, esta forma de ley simplifica la descripción de la transferencia de energía . En el proceso adiabático, el cambio de entalpía es igual al trabajo del proceso de flujo realizado en o por el sistema:
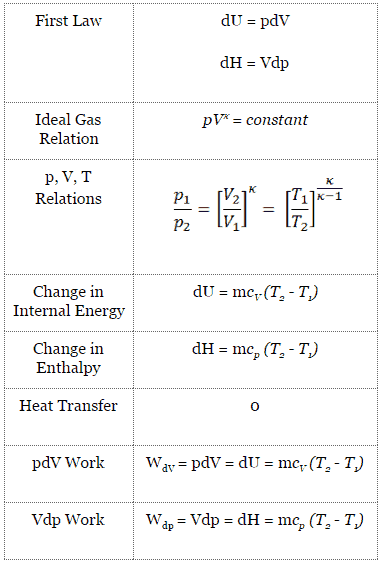
Ver también: Primera ley de la termodinámica.
Ver también: Ley del gas ideal
Ver también: Qué es la entalpía
Expansión adiabática – Compresión adiabática
Ver también: ¿Qué es un gas ideal?
En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El proceso adiabático se puede expresar con la ley de los gases ideales como:
pV κ = constante
o
p 1 V 1 κ = p 2 V 2 κ
en el que κ = c p / c v es la relación de los calores específicos (o capacidades de calor ) para el gas. Uno para presión constante (c p ) y otro para volumen constante (c v ) . Tenga en cuenta que esta relación κ = c p / c v es un factor para determinar la velocidad del sonido en un gas y otros procesos adiabáticos.
Otra relación p, V, T
En un diagrama pV , el proceso ocurre a lo largo de una línea (llamada adiabat ) que tiene la ecuación p = constante / V κ . Para un proceso ideal de gas y politrópico, el caso n = κ corresponde a un proceso adiabático.
Ejemplo de expansión adiabática
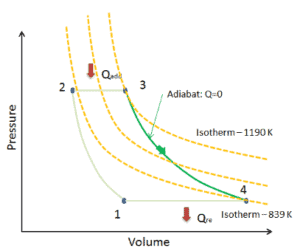
Suponga una expansión adiabática de helio ( 3 → 4 ) en una turbina de gas . Dado que el helio se comporta casi como un gas ideal , use la ley del gas ideal para calcular la temperatura de salida del gas ( T 4, real ). En estas turbinas, la etapa de alta presión recibe gas (punto 3 en la figura; p 3 = 6.7 MPa ; T 3 = 1190 K (917 ° C)) de un intercambiador de calor y lo expulsa a otro intercambiador de calor, donde la presión de salida es p 4 = 2.78 MPa (punto 4) .
Solución:
La temperatura de salida del gas, T 4, real , puede calcularse utilizando la relación p, V, T para el proceso adiabático. Tenga en cuenta que, es la misma relación que para el proceso isentrópico , por lo tanto, los resultados deben ser idénticos. En este caso, calculamos la expansión para diferentes turbinas de gas (menos eficientes) como en el caso de la expansión isentrópica en la turbina de gas.
En esta ecuación, el factor para helio es igual a κ = c p / c v = 1.66 . De la ecuación anterior se deduce que la temperatura de salida del gas, T 4, real , es:
Ver también: relación de Mayer
Proceso adiabático en turbina de gas

Supongamos el ciclo de Brayton que describe el funcionamiento de un motor térmico a presión constante . Los modernos motores de turbina de gas y los motores de inyección de aire también siguen el ciclo de Brayton.
El ciclo de Brayton consta de cuatro procesos termodinámicos. Dos procesos adiabáticos y dos procesos isobáricos.
- Compresión adiabática : el aire ambiente ingresa al compresor, donde se presuriza (1 → 2). El trabajo requerido para el compresor viene dado por W C = H 2 – H 1 .
- adición de calor isobárico : el aire comprimido pasa a través de una cámara de combustión, donde se quema el combustible y se calienta el aire u otro medio (2 → 3). Es un proceso de presión constante, ya que la cámara está abierta para fluir hacia adentro y hacia afuera. El calor neto agregado viene dado por Q add = H 3 – H 2
- Expansión adiabática : el aire calentado y presurizado se expande en la turbina y abandona su energía. El trabajo realizado por la turbina viene dado por W T = H 4 – H 3
- rechazo de calor isobárico : el calor residual debe rechazarse para cerrar el ciclo. El calor neto rechazado viene dado por Q re = H 4 – H 1
Como se puede ver, podemos describir y calcular (por ejemplo, eficiencia térmica ) tales ciclos (de manera similar para el ciclo de Rankine ) usando entalpías .
Ver también: Eficiencia térmica del ciclo de Brayton
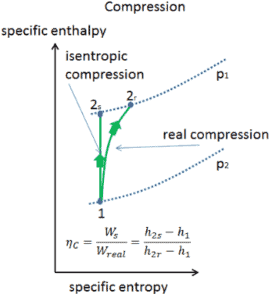
Eficiencia isentrópica: turbina, compresor, boquilla
En capítulos anteriores supusimos que la expansión del gas es isentrópica y, por lo tanto, usamos T 4, es como la temperatura de salida del gas. Estos supuestos solo son aplicables con ciclos ideales.
La mayoría de los dispositivos de flujo constante (turbinas, compresores, boquillas) funcionan en condiciones adiabáticas , pero no son realmente isentrópicos, sino que están idealizados como isentrópicos para fines de cálculo. Definimos los parámetros η T , η C , η N , como una relación entre el trabajo real realizado por el dispositivo y el trabajo del dispositivo cuando se opera en condiciones isentrópicas (en el caso de una turbina). Esta relación se conoce como la eficiencia de turbina isentrópica / compresor / boquilla .
Estos parámetros describen qué tan eficientemente una turbina, compresor o boquilla se aproxima a un dispositivo isentrópico correspondiente. Este parámetro reduce la eficiencia general y el rendimiento del trabajo. Para turbinas, el valor de η T es típicamente de 0.7 a 0.9 (70-90%).
Ejemplo: eficiencia de turbina isentrópica
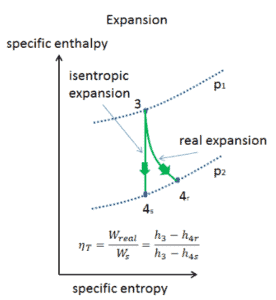
Suponga una expansión isentrópica de helio (3 → 4) en una turbina de gas. En estas turbinas, la etapa de alta presión recibe gas (punto 3 en la figura; p 3 = 6.7 MPa ; T 3 = 1190 K (917 ° C)) de un intercambiador de calor y lo expulsa a otro intercambiador de calor, donde la presión de salida es p 4 = 2.78 MPa (punto 4) . La temperatura (para el proceso isentrópico) del gas a la salida de la turbina es T 4s = 839 K (566 ° C).
Calcule el trabajo realizado por esta turbina y calcule la temperatura real a la salida de la turbina, cuando la eficiencia de la turbina isentrópica sea η T = 0.91 (91%) .
Solución:
A partir de la primera ley de la termodinámica, el trabajo realizado por la turbina en un proceso isentrópico se puede calcular a partir de:
W T = h 3 – h 4s → W Ts = c p (T 3 – T 4s )
Según la Ley del Gas Ideal, sabemos que el calor específico molar de un gas ideal monoatómico es:
C v = 3 / 2R = 12.5 J / mol K y C p = C v + R = 5 / 2R = 20.8 J / mol K
Transferimos las capacidades de calor específicas en unidades de J / kg K a través de:
c p = C p . 1 / M (peso molar de helio) = 20.8 x 4.10 -3 = 5200 J / kg K
El trabajo realizado por la turbina de gas en el proceso isentrópico es entonces:
W T, s = c p (T 3 – T 4s ) = 5200 x (1190 – 839) = 1.825 MJ / kg
El trabajo real realizado por la turbina de gas en el proceso adiabático es entonces:
W T, real = c p (T 3 – T 4s ). η T = 5200 x (1190 – 839) x 0.91 = 1.661 MJ / kg
Expansión Gratis – Expansión Joule
Estos son procesos adiabáticos en los que no se produce transferencia de calor entre el sistema y su entorno y no se realiza ningún trabajo en el sistema. Estos tipos de procesos adiabáticos se denominan expansión libre . Es un proceso irreversible en el que un gas se expande en una cámara de evacuación aislada. También se llama expansión Joule . Para un gas ideal, la temperatura no cambia (ver: Segunda Ley de Joule ), sin embargo, los gases reales experimentan un cambio de temperatura durante la expansión libre. En expansión libre, Q = W = 0, y la primera ley requiere que:
dE int = 0
No se puede trazar una expansión libre en un diagrama PV, porque el proceso es rápido, no cuasiestático. Los estados intermedios no son estados de equilibrio y, por lo tanto, la presión no está claramente definida.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.