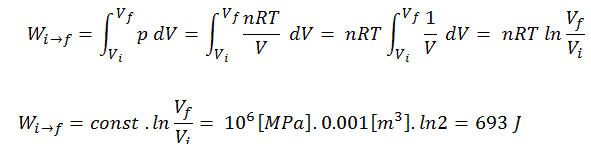Proceso isotérmico
Un proceso isotérmico es un proceso termodinámico , en el que la temperatura del sistema permanece constante (T = constante). La transferencia de calor dentro o fuera del sistema generalmente debe ocurrir a una velocidad tan lenta para ajustarse continuamente a la temperatura del depósito a través del intercambio de calor. En cada uno de estos estados se mantiene el equilibrio térmico .
Para un proceso ideal de gas y politrópico, el caso n = 1 corresponde a un proceso isotérmico (temperatura constante). A diferencia del proceso adiabático , en el que n = κ y un sistema no intercambia calor con su entorno (Q = 0; ∆T ≠ 0 ) , en un proceso isotérmico no hay cambio en la energía interna (debido a ∆T = 0 ) y, por lo tanto, ΔU = 0 (para gases ideales) y Q ≠ 0. Un proceso adiabático no es necesariamente un proceso isotérmico, ni un proceso isotérmico es necesariamente adiabático.
En ingeniería, los cambios de fase, como la evaporación o la fusión, son procesos isotérmicos cuando, como suele ser el caso, ocurren a presión y temperatura constantes.
Proceso isotérmico y la primera ley
La forma clásica de la primera ley de la termodinámica es la siguiente ecuación:
dU = dQ – dW
En esta ecuación, dW es igual a dW = pdV y se conoce como el trabajo límite .
En el proceso isotérmico y el gas ideal , todo el calor agregado al sistema se utilizará para hacer el trabajo:
Proceso isotérmico (dU = 0):
dU = 0 = Q – W → W = Q (para gas ideal)
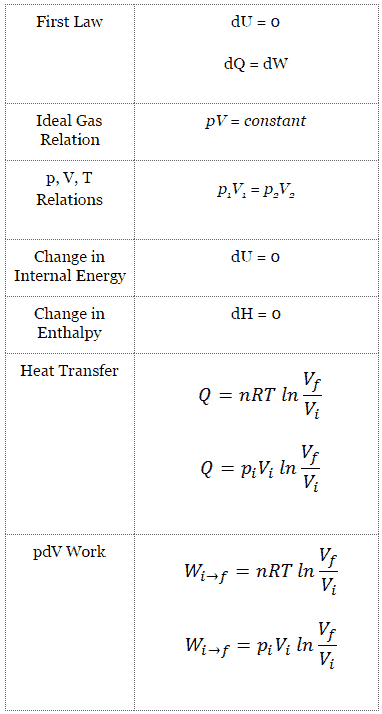

Expansión Isotérmica – Compresión Isotérmica
Ver también: ¿Qué es un gas ideal?
 En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
En un gas ideal , las moléculas no tienen volumen y no interactúan. Según la ley de los gases ideales , la presión varía linealmente con la temperatura y la cantidad, e inversamente con el volumen .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
El proceso isotérmico se puede expresar con la ley de los gases ideales como:
pV = constante
o
p 1 V 1 = p 2 V 2
En un diagrama de pV, el proceso se produce a lo largo de una línea (llamada una isoterma) que tiene la ecuación p = constante / V .
Ley de Boyle-Mariotte
La Ley Boyle-Mariotte es una de las leyes de los gases . A finales del siglo XVII, Robert William Boyle y Edme Mariotte estudiaron independientemente la relación entre el volumen y la presión de un gas a temperatura constante . Los resultados de ciertos experimentos con gases a una presión relativamente baja llevaron a Robert Boyle a formular una ley bien conocida. Se afirma que:
Para una masa fija de gas a temperatura constante, el volumen es inversamente proporcional a la presión.
Eso significa que, por ejemplo, si aumenta el volumen 10 veces, la presión disminuirá 10 veces. Si reduce a la mitad el volumen, duplicará la presión.
Puede expresar esto matemáticamente como:
pV = constante
o
p 1 V 1 = p 2 V 2
Sí, parece ser idéntico al proceso isotérmico de gas ideal. De hecho, durante sus experimentos la temperatura se mantiene constante, como supuso Mariotte. Estos resultados son totalmente consistentes con la ley de los gases ideales , que determina que la constante es igual a nRT .
pV = nRT
dónde:
- p es la presión absoluta del gas
- n es la cantidad de sustancia
- T es la temperatura absoluta
- V es el volumen
- R es la constante de gas ideal, o universal, igual al producto de la constante de Boltzmann y la constante de Avogadro,
En esta ecuación, el símbolo R es una constante llamada constante de gas universal que tiene el mismo valor para todos los gases, es decir, R = 8.31 J / mol K.
Ejemplo de proceso isotérmico
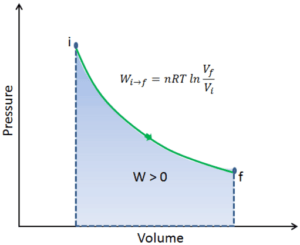
Suponga una expansión isotérmica de helio (i → f) en un pistón sin fricción (sistema cerrado). La expansión del gas es impulsada por la absorción de energía térmica Q add . El gas se expande desde el volumen inicial de 0.001 m 3 y simultáneamente la carga externa del pistón disminuye lenta y continuamente de 1 MPa a 0.5 MPa. Dado que el helio se comporta casi como un gas ideal, use la ley del gas ideal para calcular el volumen final de la cámara y luego calcule el trabajo realizado por el sistema, cuando la temperatura del gas es igual a 400 K.
Solución:
El volumen final del gas, V f , puede calcularse utilizando la relación p, V, T para el proceso isotérmico:
p i V i = p f V f ⇒ V f = p i V i / p f = 2 x 0.001 m 3 = 0.002 m 3
Para calcular tales procesos, necesitaríamos saber cómo la presión varía con el volumen para el proceso real por el cual el sistema cambia del estado i al estado f . Como durante este proceso la presión interna no fue constante, el trabajo p∆V realizado por el pistón debe calcularse utilizando la siguiente integral:
Por convención, un valor positivo para el trabajo indica que el trabajo lo realiza el sistema en su entorno. Un valor negativo indica que el trabajo se realiza en el sistema por su entorno. El trabajo pΔV es igual al área bajo la curva de proceso trazada en el diagrama de presión-volumen.
Expansión Gratis – Expansión Joule
Estos son procesos adiabáticos en los que no se produce transferencia de calor entre el sistema y su entorno y no se realiza ningún trabajo en el sistema. Estos tipos de procesos adiabáticos se denominan expansión libre . Es un proceso irreversible en el que un gas se expande en una cámara de evacuación aislada. También se llama expansión Joule . Para un gas ideal, la temperatura no cambia (esto significa que el proceso también es isotérmico ) , sin embargo, los gases reales experimentan un cambio de temperatura durante la expansión libre. En expansión libre, Q = W = 0, y la primera ley requiere que:
dE int = 0
No se puede trazar una expansión libre en un diagrama PV, porque el proceso es rápido, no cuasiestático. Los estados intermedios no son estados de equilibrio y, por lo tanto, la presión no está claramente definida.
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.