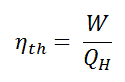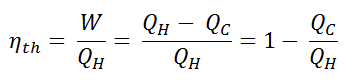Leyes de termodinámica
Existen cuatro leyes de la termodinámica que definen cantidades físicas fundamentales (temperatura, energía y entropía) y que caracterizan los sistemas termodinámicos en equilibrio térmico . Estas son consideradas como una de las leyes más importantes en toda la física. Las leyes son las siguientes:
Si dos sistemas están en equilibrio térmico con un tercero, entonces están en equilibrio térmico entre sí.
Esta ley proporciona una definición y un método para definir temperaturas, quizás la propiedad intensiva más importante de un sistema cuando se trata de problemas de conversión de energía térmica.
Primera ley de la termodinámica:
El aumento de la energía interna de un sistema cerrado es igual al calor suministrado al sistema menos el trabajo realizado por él.
Esta ley es el principio de conservación de la energía . Es la ley más importante para el análisis de la mayoría de los sistemas y la que cuantifica cómo se transforma la energía térmica en otras formas de energía . De ello se deduce que las máquinas de movimiento perpetuo del primer tipo son imposibles.
Segunda ley de la termodinámica:
La entropía de cualquier sistema aislado nunca disminuye. En un proceso termodinámico natural, aumenta la suma de las entropías de los sistemas termodinámicos que interactúan.
Esta ley indica la irreversibilidad de los procesos naturales . Los procesos reversibles son una ficción teórica útil y conveniente, pero no ocurren en la naturaleza. De esta ley se deduce que es imposible construir un dispositivo que funcione en un ciclo y cuyo único efecto sea la transferencia de calor de un cuerpo más frío a un cuerpo más caliente. De ello se deduce que las máquinas de movimiento perpetuo del segundo tipo son imposibles.
Tercera ley de la termodinámica:
La entropía de un sistema se aproxima a un valor constante a medida que la temperatura se acerca al cero absoluto.
Basado en evidencia empírica, esta ley establece que la entropía de una sustancia cristalina pura es cero en el cero absoluto de temperatura , 0 K y que es imposible mediante cualquier proceso, sin importar cuán idealizado esté, reducir la temperatura de un sistema a cero absoluto en un número finito de pasos. Esto nos permite definir un punto cero para la energía térmica de un cuerpo.
Versión popular de las leyes de la termodinámica
0. Debes jugar el juego.
1. No puedes ganar; solo puedes alcanzar el equilibrio.
2. Solo puede alcanzar el punto de equilibrio en el cero absoluto.
3. No puedes alcanzar el cero absoluto.
Trabajo y calor en termodinámica
Calor en termodinámica
Ver también: calor en termodinámica
Ver también: trabajo en termodinámica
Mientras que la energía interna se refiere a la energía total de todas las moléculas dentro del objeto, el calor es la cantidad de energía que fluye de un cuerpo a otro de forma espontánea debido a su diferencia de temperatura. El calor es una forma de energía, pero es energía en tránsito . El calor no es una propiedad de un sistema. Sin embargo, la transferencia de energía como calor ocurre a nivel molecular como resultado de una diferencia de temperatura .
Considere un bloque de metal a alta temperatura, que consiste en átomos que oscilan intensamente alrededor de sus posiciones promedio. A bajas temperaturas , los átomos continúan oscilando, pero con menos intensidad . Si un bloque de metal más caliente se pone en contacto con un bloque más frío, los átomos que oscilan intensamente en el borde del bloque más caliente emiten su energía cinética a los átomos menos oscilantes en el borde del bloque frío. En este caso, hay una transferencia de energía entre estos dos bloques y el calor fluye del bloque más caliente al más frío por estas vibraciones aleatorias.
En general, cuando dos objetos se ponen en contacto térmico , el calor fluirá entre ellos hasta que se equilibren entre sí. Cuando existe una diferencia de temperatura , el calor fluye espontáneamente del sistema más cálido al sistema más frío . La transferencia de calor ocurre por conducción o por radiación térmica . Cuando se detiene el flujo de calor , se dice que están a la misma temperatura . Luego se dice que están en equilibrio térmico .
Al igual que con el trabajo, la cantidad de calor transferido depende de la ruta y no simplemente de las condiciones iniciales y finales del sistema. En realidad, hay muchas maneras de llevar el gas del estado i al estado f.
Además, como con el trabajo, es importante distinguir entre el calor agregado a un sistema de su entorno y el calor eliminado de un sistema a su entorno. Q es positivo para el calor agregado al sistema, por lo que si el calor sale del sistema, Q es negativo. Debido a que W en la ecuación es el trabajo realizado por el sistema, entonces si el trabajo se realiza en el sistema, W será negativo y E int aumentará.
El símbolo q a veces se usa para indicar el calor agregado o eliminado de un sistema por unidad de masa . Es igual al calor total (Q) agregado o eliminado dividido por la masa (m).
Trabajo en termodinámica
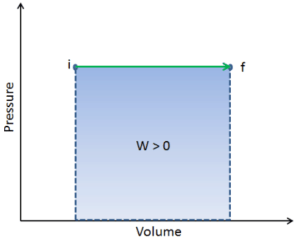
En termodinámica, el trabajo realizado por un sistema es la energía transferida por el sistema a su entorno. La energía cinética, la energía potencial y la energía interna son formas de energía que son propiedades de un sistema. El trabajo es una forma de energía , pero es energía en tránsito . Un sistema no contiene trabajo, el trabajo es un proceso realizado por o en un sistema. En general, el trabajo se define para sistemas mecánicos como la acción de una fuerza sobre un objeto a través de una distancia.
W = F. re
dónde:
W = trabajo (J)
F = fuerza (N)
d = desplazamiento (m)
Motores de calor y eficiencia térmica
Las fuentes de energía siempre han jugado un papel muy importante en el desarrollo de la sociedad humana. La energía se define generalmente como el potencial para hacer trabajo o producir calor . A veces es como la “moneda” para realizar el trabajo. Una de las propiedades más maravillosas del universo es que la energía puede transformarse de un tipo a otro y transferirse de un objeto a otro .
En general, es fácil producir energía térmica haciendo trabajo , por ejemplo, mediante cualquier proceso de fricción. Pero obtener trabajo de la energía térmica es más difícil . Está estrechamente asociado con el concepto de entropía . Por ejemplo, la electricidad es particularmente útil ya que tiene una entropía muy baja (está muy ordenada) y puede convertirse en otras formas de energía de manera muy eficiente .
A veces, la energía mecánica está directamente disponible, por ejemplo, la energía eólica y la energía hidroeléctrica. Pero la mayor parte de nuestra energía proviene de la quema de combustibles fósiles (carbón, petróleo y gas) y de reacciones nucleares . En la actualidad, el combustible fósil sigue siendo la fuente de energía predominante del mundo. Pero la quema de combustibles fósiles genera solo energía térmica , por lo tanto, estas fuentes de energía se denominan ” fuentes de energía primaria “, que deben convertirse en fuente de energía secundaria , los llamados portadores de energía ( energía eléctrica, etc.). Para convertir la energía térmica en otra forma de energía, un motor térmico debe ser usado.
En general, un motor térmico es un dispositivo que convierte la energía química en calor o energía térmica y luego en energía mecánica o eléctrica. Muchos motores térmicos funcionan de manera cíclica, agregando energía en forma de calor en una parte del ciclo y utilizando esa energía para realizar un trabajo útil en otra parte del ciclo.
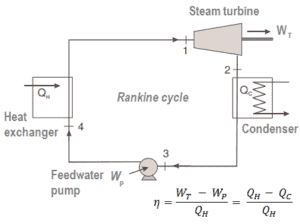
Por ejemplo, como es típico en todas las centrales térmicas convencionales , el calor se utiliza para generar vapor que impulsa una turbina de vapor conectada a un generador que produce electricidad. Los generadores de vapor, turbinas de vapor, condensadores y bombas de agua de alimentación constituyen un motor térmico , sujeto a las limitaciones de eficiencia impuestas por la segunda ley de la termodinámica . En las centrales nucleares modernas, la eficiencia termodinámica general es de aproximadamente un tercio (33%), por lo que se necesitan 3000 MWth de energía térmica de la reacción de fisión para generar 1000 MWe de energía eléctrica.
Ver también: motores de calor
Eficiencia térmica
Se define la eficiencia térmica , η º , de cualquier motor térmico como la relación entre el trabajo que hace, W , para el calor de entrada a la alta temperatura, Q H .
La eficiencia térmica , η th , representa la fracción de calor , Q H , que se convierte en trabajo . Es una medida de rendimiento sin dimensiones de un motor térmico que utiliza energía térmica, como una turbina de vapor, un motor de combustión interna o un refrigerador. Para una bomba de refrigeración o de calor, la eficiencia térmica indica el grado en que la energía agregada por el trabajo se convierte en salida neta de calor. Como es un número adimensional, siempre debemos expresar W, Q H y Q C en las mismas unidades.
Dado que la energía se conserva de acuerdo con la primera ley de la termodinámica y la energía no se puede convertir en trabajo por completo, la entrada de calor, Q H , debe ser igual al trabajo realizado, W, más el calor que se debe disipar como calor residual Q C en el ambiente. Por lo tanto, podemos reescribir la fórmula para la eficiencia térmica como:
Para dar la eficiencia como un porcentaje, multiplicamos la fórmula anterior por 100. Tenga en cuenta que, η th podría ser 100% solo si el calor residual Q C será cero.
En general, la eficiencia de incluso los mejores motores térmicos es bastante baja. En resumen, es muy difícil de convertir la energía térmica a la energía mecánica . Las eficiencias térmicas suelen ser inferiores al 50% y, a menudo, muy inferiores. Tenga cuidado cuando lo compara con la eficiencia de la energía eólica o hidroeléctrica (las turbinas eólicas no son motores de calor), no hay conversión de energía entre la energía térmica y mecánica.
Ver también: Principio de Carnot
Ver también: eficiencia térmica
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.