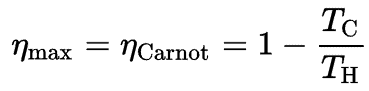Ciclo de Carnot – Procesos
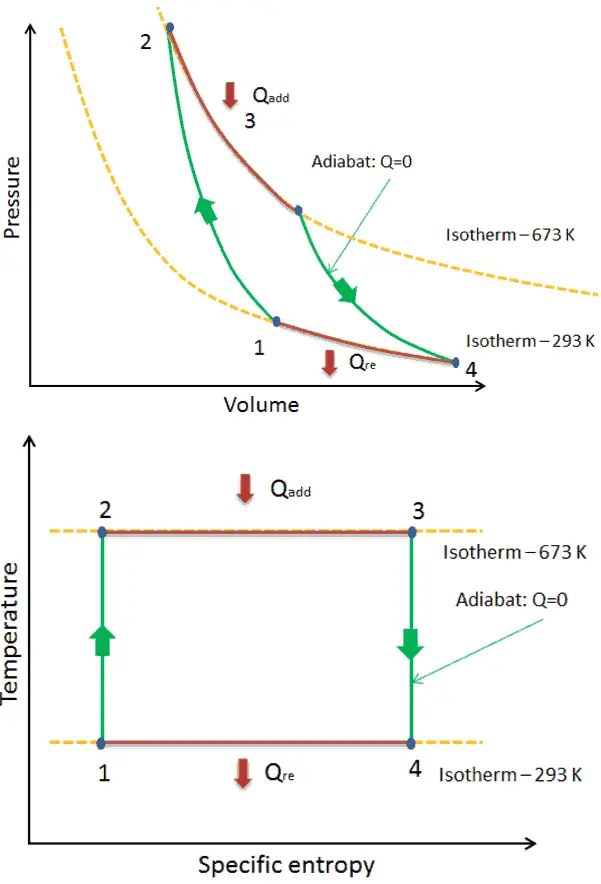 En un ciclo de Carnot , el sistema que ejecuta el ciclo experimenta una serie de cuatro procesos internamente reversibles : dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isotérmicos :
En un ciclo de Carnot , el sistema que ejecuta el ciclo experimenta una serie de cuatro procesos internamente reversibles : dos procesos isentrópicos (adiabáticos reversibles) alternados con dos procesos isotérmicos :
- compresión isoentrópica – El gas se comprime adiabáticamente del estado 1 al estado 2, donde la temperatura es T H . Los alrededores trabajan con el gas, aumentando su energía interna y comprimiéndolo. Por otro lado, la entropía permanece sin cambios .
- Isotérmica expansión – El sistema se coloca en contacto con el depósito en T H . El gas se expande isotérmicamente mientras recibe energía Q H del depósito caliente por transferencia de calor. La temperatura del gas no cambia durante el proceso. El gas funciona en los alrededores. El cambio total de entropía viene dado por: ∆S = S 1 – S 4 = Q H / T H
- expansión isoentrópica – El gas se expande adiabáticamente del estado 3 al estado 4, donde la temperatura es T C . El gas funciona en el entorno y pierde una cantidad de energía interna igual al trabajo que abandona el sistema. Nuevamente, la entropía permanece sin cambios.
- isotérmica de compresión – El sistema se coloca en contacto con el depósito en T C . El gas se comprime isotérmicamente a su estado inicial mientras descarga energía Q C al depósito frío por transferencia de calor. En este proceso, los alrededores trabajan con el gas. El cambio total de entropía viene dado por: ∆S = S 3 – S 2 = Q C / T C
Eficiencia del ciclo de Carnot
En, el general eficiencia térmica , η º , de cualquier motor de calor se define como la relación de la red de trabajo que hace, W , para el calor de entrada a la alta temperatura, Q H .
Dado que la energía se conserva de acuerdo con la primera ley de la termodinámicay la energía no se puede convertir en trabajo por completo, la entrada de calor, Q H , debe ser igual al trabajo realizado, W, más el calor que se debe disipar como calor residual Q C en el ambiente. Por lo tanto, podemos reescribir la fórmula para la eficiencia térmica como:
Dado que Q C = ∆ST C y Q H = ∆ST H , la fórmula para esta eficiencia máxima es:
dónde:
- es la eficiencia del ciclo de Carnot, es decir, es la relación = W / Q H del trabajo realizado por el motor a la energía térmica que ingresa al sistema desde el depósito caliente.
- T C es la temperatura absoluta (Kelvins) del depósito frío,
- T H es la temperatura absoluta (Kelvins) del depósito caliente.
Ver también: causas de ineficiencias
Ejemplo: eficiencia de Carnot para una central eléctrica de carbón
En una moderna planta de energía de carbón , la temperatura del vapor de alta presión (T caliente ) sería de unos 400 ° C (673K) y T frío , la temperatura de agua de la torre de refrigeración, sería de alrededor de 20 ° C (293 K). Para este tipo de planta de energía, la eficiencia máxima (ideal) será:
η th = 1 – T frío / T caliente = 1 – 293/673 = 56%
Debe agregarse, esta es una eficiencia idealizada . La eficiencia de Carnot es válida para procesos reversibles. Estos procesos no pueden lograrse en ciclos reales de centrales eléctricas. La eficiencia de Carnot dicta que se pueden lograr mayores eficiencias aumentando la temperatura del vapor. Esta característica es válida también para ciclos termodinámicos reales. Pero esto requiere un aumento de las presiones dentro de las calderas o generadores de vapor . Sin embargo, las consideraciones metalúrgicas ponen límites superiores a tales presiones. Las plantas de energía de combustible fósil subcrítico, que funcionan bajo presión crítica (es decir, por debajo de 22.1 MPa), pueden lograr una eficiencia de 36 a 40%. Diseños supercríticos, que funcionan a presión supercrítica(es decir, superior a 22.1 MPa), tienen eficiencias alrededor del 43%. Las centrales eléctricas de carbón más eficientes y también muy complejas que funcionan a presiones “ultra críticas” (es decir, alrededor de 30 MPa) y usan recalentamiento de etapas múltiples alcanzan aproximadamente el 48% de eficiencia.
Ver también: Reactor supercrítico
……………………………………………………………………………………………………………………………….
Este artículo se basa en la traducción automática del artículo original en inglés. Para más información vea el artículo en inglés. Puedes ayudarnos. Si desea corregir la traducción, envíela a: translations@nuclear-power.com o complete el formulario de traducción en línea. Agradecemos su ayuda, actualizaremos la traducción lo antes posible. Gracias.