Processus thermodynamiques
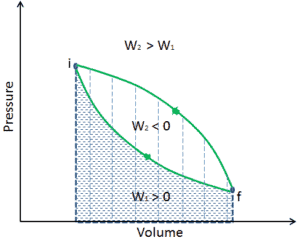
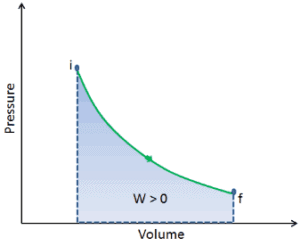 Un processus thermodynamique est défini comme un changement d’un macrostate d’équilibre à un autre macrostate. Les états initial et final sont les éléments déterminants du processus. Au cours d’un tel processus, un système part d’un état initial i , décrit par une pression p i , un volume V i et une température T i , passe par différents états quasi statiques jusqu’à un état final f , décrit par une pression p f , a le volume V f et une température T f . Dans ce processusl’énergie peut être transférée sous forme ou dans le système et le travail peut également être effectué par ou sur le système. Un exemple de processus thermodynamique est l’augmentation de la pression d’un gaz tout en maintenant une température constante. Dans la section suivante, il existe des exemples de processus thermodynamiques qui sont de la plus haute importance dans l’ingénierie des moteurs thermiques .
Un processus thermodynamique est défini comme un changement d’un macrostate d’équilibre à un autre macrostate. Les états initial et final sont les éléments déterminants du processus. Au cours d’un tel processus, un système part d’un état initial i , décrit par une pression p i , un volume V i et une température T i , passe par différents états quasi statiques jusqu’à un état final f , décrit par une pression p f , a le volume V f et une température T f . Dans ce processusl’énergie peut être transférée sous forme ou dans le système et le travail peut également être effectué par ou sur le système. Un exemple de processus thermodynamique est l’augmentation de la pression d’un gaz tout en maintenant une température constante. Dans la section suivante, il existe des exemples de processus thermodynamiques qui sont de la plus haute importance dans l’ingénierie des moteurs thermiques .
Types de processus thermodynamiques
Processus réversible
En thermodynamique, un processus réversible est défini comme un processus qui peut être inversé en induisant des changements infinitésimaux à certaines propriétés du système et, ce faisant, ne laisse aucun changement ni dans le système ni dans l’environnement. Pendant le processus réversible, l’ entropie du système n’augmente pas et le système est en équilibre thermodynamique avec son environnement.
Processus irréversible
En thermodynamique, un processus irréversible est défini comme un processus qui ne peut pas être inversé, processus, qui ne peut pas remettre à la fois le système et l’environnement dans leurs conditions d’origine.
Pendant le processus irréversible, l’ entropie du système augmente .
Processus cyclique
Un processus qui ramène finalement un système à son état initial est appelé processus cyclique . À la fin d’un cycle, toutes les propriétés ont la même valeur qu’au début. Pour un tel processus, l’ état final est le même que l’état initial , et donc le changement d’ énergie interne total doit être nul.
Il faut noter que, selon la deuxième loi de la thermodynamique , toute la chaleur fournie à un cycle ne peut pas être transformée en une quantité égale de travail, une certaine réjection de chaleur doit avoir lieu. Le rendement thermique , η e , d’un moteur thermique en tant que rapport du travail qu’il fait, W , à la chaleur d’ entrée à la température élevée, Q H . η e = W / Q H .
Voir aussi: Processus réversible
Voir aussi: Processus irréversible
Voir aussi: Processus cyclique
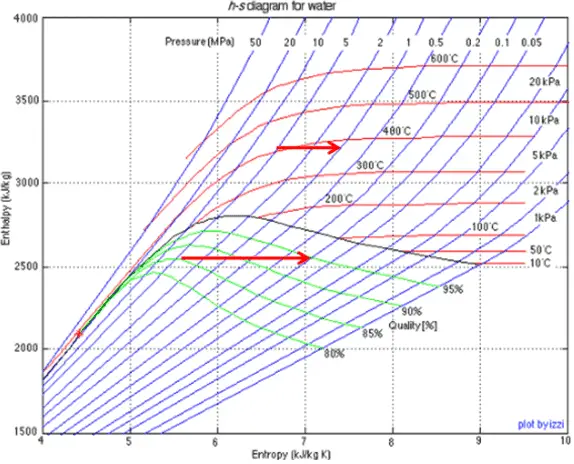
Processus isentropique
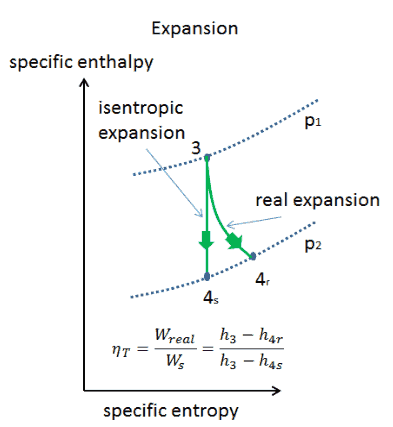
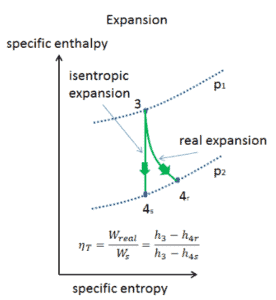
Un processus isentropique est un processus thermodynamique , dans lequel l’ entropiedu fluide ou du gaz reste constante. Cela signifie que le processus isentropique est un cas particulier d’un processus adiabatique dans lequel il n’y a pas de transfert de chaleur ou de matière. Il s’agit d’un processus adiabatique réversible . Un processus isentropique peut également être appelé un processus d’entropie constante. En ingénierie, un tel processus idéalisé est très utile pour la comparaison avec des processus réels.
Voir aussi: Processus isentropique
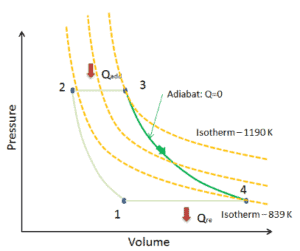
Diagramme PV d’une expansion isentropique de l’hélium (3 → 4) dans une turbine à gaz.
Processus adiabatique
Un processus adiabatique est un processus thermodynamique , dans lequel il n’y a pas de transfert de chaleur dans ou hors du système (Q = 0). Le système peut être considéré comme parfaitement isolé . Dans un processus adiabatique, l’énergie n’est transférée que sous forme de travail. L’hypothèse d’absence de transfert de chaleur est très importante, car nous ne pouvons utiliser l’approximation adiabatique que dans des processus très rapides . Dans ces processus rapides, il n’y a pas assez de temps pour que le transfert d’énergie sous forme de chaleur ait lieu vers ou depuis le système.
Dans les appareils réels (tels que les turbines, les pompes et les compresseurs), des pertes de chaleur et des pertes dans le processus de combustion se produisent, mais ces pertes sont généralement faibles par rapport au flux d’énergie global et nous pouvons approximer certains processus thermodynamiques par le processus adiabatique.
Voir aussi: Processus adiabatique
Expansion isentropique vs adiabatique
Processus isotherme
Un processus isotherme est un processus thermodynamique , dans lequel la température du système reste constante (T = const). Le transfert de chaleur dans ou hors du système doit généralement se produire à un rythme aussi lent afin de s’adapter en permanence à la température du réservoir par échange de chaleur. Dans chacun de ces états, l’ équilibre thermique est maintenu.
Pour un gaz parfait et un procédé polytropique, le cas n = 1 correspond à un procédé isotherme (à température constante). Contrairement au processus adiabatique , dans lequel n = κ et un système n’échange pas de chaleur avec son environnement (Q = 0; ∆T ≠ 0 ) , dans un processus isotherme, il n’y a pas de changement dans l’énergie interne (due à ∆T = 0 ) et donc ΔU = 0 (pour les gaz idéaux) et Q ≠ 0. Un processus adiabatique n’est pas nécessairement un processus isotherme, ni un processus isotherme nécessairement adiabatique.
Voir aussi: Processus isotherme
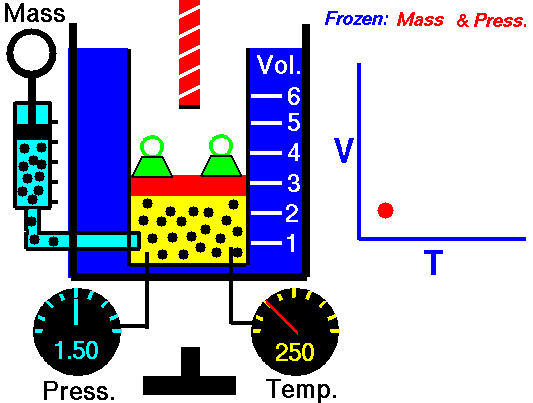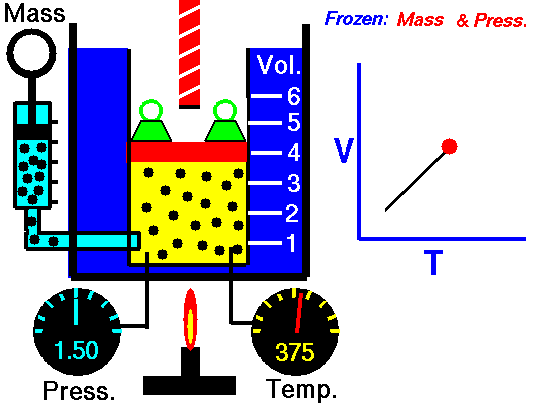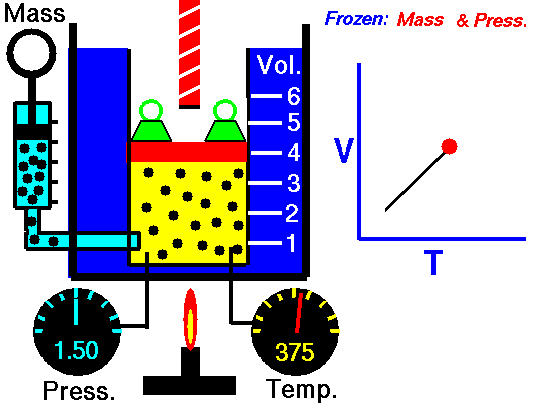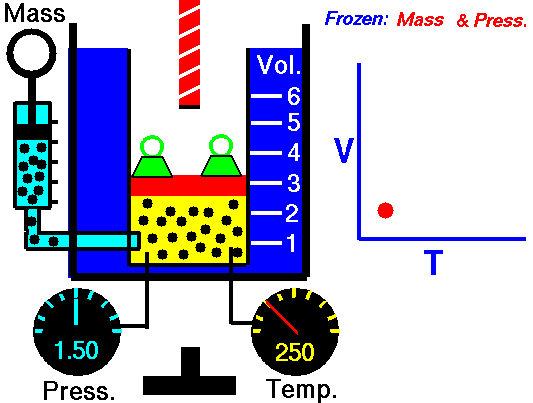
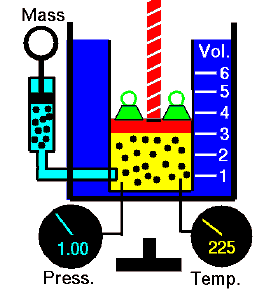
Loi de Boyle-Mariotte. Pour une masse fixe de gaz à température constante, le volume est inversement proportionnel à la pression. Source: grc.nasa.gov La politique de la NASA sur le droit d’auteur stipule que «le matériel de la NASA n’est pas protégé par le droit d’auteur, sauf indication contraire»
Processus isobare
Un processus isobare est un processus thermodynamique , dans lequel la pression du système reste constante (p = const). Le transfert de chaleur dans ou hors du système fonctionne, mais modifie également l’énergie interne du système.
Puisqu’il y a des changements d’ énergie interne (dU) et des changements de volume du système (∆V), les ingénieurs utilisent souvent l’ enthalpie du système, qui est définie comme:
H = U + pV
Dans de nombreuses analyses thermodynamiques, il est commode d’utiliser l’ enthalpie au lieu de l’énergie interne. Surtout dans le cas de la première loi de la thermodynamique .
En ingénierie, les deux cycles thermodynamiques très importants (cycle de Brayton et cycle de Rankine ) sont basés sur deux processus isobares , donc l’étude de ce processus est cruciale pour les centrales électriques.
Voir aussi: Processus isobare
Pour une masse fixe de gaz à pression constante, le volume est directement proportionnel à la température Kelvin. Source: grc.nasa.gov La politique de la NASA sur le droit d’auteur stipule que «le matériel de la NASA n’est pas protégé par le droit d’auteur, sauf indication contraire»
Processus isochorique
Un processus isochore est un processus thermodynamique, dans lequel le volume du système fermé reste constant (V = const). Il décrit le comportement du gaz à l’intérieur du conteneur, qui ne peut pas être déformé. Étant donné que le volume reste constant, le transfert de chaleur dans ou hors du système ne fonctionne pas avec le p∆V , mais modifie uniquement l’ énergie interne (la température) du système.
Dans l’ingénierie des moteurs à combustion interne , les processus isochoriques sont très importants pour leurs cycles thermodynamiques (cycle Otto et Diesel), donc l’étude de ce processus est cruciale pour l’ingénierie automobile.
Voir aussi: Processus isochorique
Pour une masse fixe de gaz à volume constant, la pression est directement proportionnelle à la température Kelvin
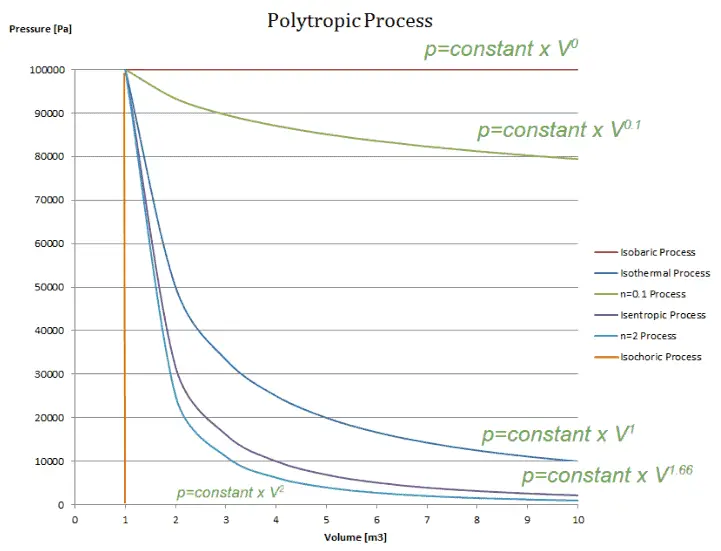
Processus polytropique
Un processus polytropique est tout processus thermodynamique qui peut être exprimé par l’équation suivante:
pV n = constant
Le processus polytropique peut décrire l’expansion et la compression des gaz qui incluent le transfert de chaleur . L’exposant n est connu comme l’ indice polytropique et il peut prendre n’importe quelle valeur de 0 à ∞, selon le processus particulier.
Voir aussi: Processus polytropique
Processus polytropiques avec divers indices polytropiques
Processus de limitation – Processus isenthalpique
Un processus d’étranglement est un processus thermodynamique , dans lequel l’ enthalpie du gaz ou du milieu reste constante (h = const) . En fait, le processus d’étranglement est l’un des processus isenthalpiques . Pendant le processus d’étranglement, aucun travail n’est effectué par ou sur le système (dW = 0), et généralement il n’y a pas de transfert de chaleur ( adiabatique ) depuis ou vers le système (dQ = 0). De l’autre, le processus d’étranglement ne peut pas être isentropique, c’est un processus fondamentalement irréversible . Caractéristiques du processus d’étranglement:
- Pas de transfert de travail
- Pas de transfert de chaleur
- Processus irréversible
- Processus isenthalpique
L’étranglement de la vapeur humide est également associé à la conservation de l’enthalpie . Mais dans ce cas, une diminution de la pression entraîne une augmentation de la qualité de la vapeur .
Voir aussi: Processus de limitation
……………………………………………………………………………………………………………………………….
Cet article est basé sur la traduction automatique de l’article original en anglais. Pour plus d’informations, voir l’article en anglais. Pouvez vous nous aider Si vous souhaitez corriger la traduction, envoyez-la à l’adresse: translations@nuclear-power.com ou remplissez le formulaire de traduction en ligne. Nous apprécions votre aide, nous mettrons à jour la traduction le plus rapidement possible. Merci